
题目列表(包括答案和解析)
21. (l4分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
|
族 周期 |
IA |
|
0 |
|||||
|
1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
② |
③ |
④ |
|
|
|
3 |
⑤ |
|
⑥ |
⑦ |
|
|
⑧ |
|
(1)④、⑤、⑥的原子半径由大到小的顺序为 。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是 。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的化合物,写出其中两种化合物的化学式: 、 。
(4)由表中两种元素的原子按1︰1组成的常见液态化合物的稀液易被MnO2 催化分解,向酸性FeCl2溶液中先加入KSCN,再加入该溶液,现象是 ,
反应的离子方程式是 , 。
(5)已知:O2(g) = O2+(g)+e-
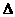 H1= 1175.7 kJ·mol-1
H1= 1175.7 kJ·mol-1
PtF6-(g) =PtF6(g)+e-
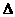 H2= +771.1 kJ·mol-1
H2= +771.1 kJ·mol-1
O2+(g)+PtF6-(g) =O2PtF6(S)
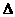 H3= -482.2 kJ·mol-1
H3= -482.2 kJ·mol-1
则反应O2(g)+PtF6(g)
= O2PtF6 (s)的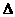 H=_____________ kJ·mol-1。
H=_____________ kJ·mol-1。
20. (8分)SO2是一种重要的化工原料,也是引起酸雨污染的重要来源。
(1)下列有关酸雨的说法正确的是 (填序号)。
A. SO2、NO2或CO2都会导致酸雨的形成
B. NO不溶于水,所以不会造成酸雨污染
C. 燃煤时鼓入足量空气,可以减少酸雨的产生
 D. 采用清洁能源,可以减少酸雨的产生
D. 采用清洁能源,可以减少酸雨的产生
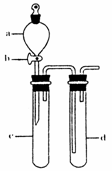
(2)某兴趣小组采用右图装置制取并探究SO2气体的性质。
①下列实验方案适用于用右图所示装置制取所需SO2的是
(填序号)。
A. Na2SO3溶液与HNO3 B. Na2SO3固体与浓硫酸
C. 固体硫在纯氧中燃烧 D.铜与浓H2SO4
②组装完仪器后,检查装置气密性的方法是:关闭活塞b,
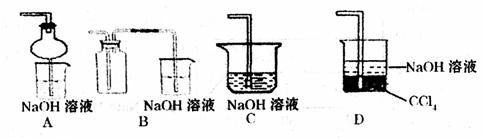
③指导老师指出应增加一尾气吸收装置,并帮助同学们设计了如下装置,其中合理的是
(填序号)。
19.(14分)对金属制品进行抗腐蚀处理,可延长其使用寿命。
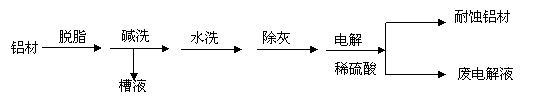 (1)以下为铝材表面处理的一种方法:
(1)以下为铝材表面处理的一种方法:
①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是______(用离子方程式表示)。为将碱洗槽液中铝以沉淀形式回收,最好向槽液中加入下列试剂中的_____。
a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,铁为阴极,在H2SO4 溶液中电解,铝材表面形成一层致密氧化膜,铁表面有无色无味气体放出,则阳极电极反应为 。阴极电极反应为 。
(2)镀铜可防止铁制品腐蚀,电镀时用铜作阳极而不用石墨作阳极的原因是______。
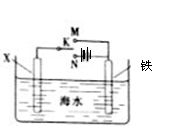
(3)利用右图装置,可以模拟铁的电化学防护。
若X为碳棒,为减缓铁的腐蚀,开关K应置于______处。
若X为锌,开关K置于M处,该电化学防护法称为_______。
18.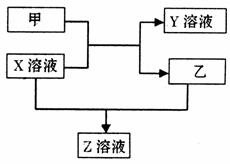 (13分)甲、乙是同主族非金属元素组成的单质,乙通常状况下是深红棕色液体。X、Y、Z是化合物。X溶液呈淡绿色,Y、Z的溶液都能使KSCN溶液变红。它们之间有如下图所示转化关系。
(13分)甲、乙是同主族非金属元素组成的单质,乙通常状况下是深红棕色液体。X、Y、Z是化合物。X溶液呈淡绿色,Y、Z的溶液都能使KSCN溶液变红。它们之间有如下图所示转化关系。
请回答:
(1)将Y的饱和溶液滴入沸水中,继续加热可得红褐色液体,此液体不具有的性质是
A. 光束通过该液体时形成光亮的“通路”
B. 插入电极通过直流电后,有一极附近液体颜色加深
C. 向该液体中加入硝酸银溶液,无沉淀产生
D. 将该液体加热蒸干、灼烧后,有氧化物生成
(2)①单质甲、乙和Y溶液中的阳离子氧化性由强到弱的顺序为: (用化学式表示)
②少量单质甲通入X溶液中发生的离子方程式为
 (3)实验室制备、收集纯净干燥的甲单质,所需仪器如下,装置A为发生装置;除装置A中所需的药品外,其他装置中供选择的药品有:浓硫酸、碱石灰、五氧化二磷、饱和食盐水、氢氧化钠溶液。
(3)实验室制备、收集纯净干燥的甲单质,所需仪器如下,装置A为发生装置;除装置A中所需的药品外,其他装置中供选择的药品有:浓硫酸、碱石灰、五氧化二磷、饱和食盐水、氢氧化钠溶液。
①装置A中发生反应的化学反应方程式:
②按气流的方向连接各仪器接口,顺序为
a→ → → → →f。
③指出装置B、C、E中的药品(从提供的药品中选择):
B: C: E:
17.  和
和 是氧元素的两种核素,
是氧元素的两种核素,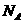 表示阿伏伽德罗常数,下列说法正确的是
表示阿伏伽德罗常数,下列说法正确的是
A.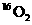 与
与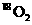 互为同分异构体
互为同分异构体
B.  与
与 核外电子排布方式不同
核外电子排布方式不同
C.通过化学变化可以实现 与
与 间的相互转化
间的相互转化
D.标准状况下,1.12L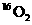 和1.12L
和1.12L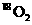 均含有0.1
均含有0.1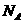 个氧原子
个氧原子
第Ⅱ卷(非选择题,共49分)
16. X、Y、Z、W有如右图所示的转化关系,则X、Y可能是( )
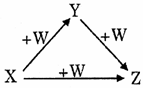 ①C、CO
②AlCl3、Al(OH)3
①C、CO
②AlCl3、Al(OH)3
③Fe、FeCl3 ④Na2CO3、NaHCO3
A. 只有①② B. 只有③④
C. 只有①②④ D. ①②③④
15. 已知NA代表阿伏加德罗常数,下列说法正确的是
A. 224mL氧气和氮气的混合气体的分子数为0.01NA
B. 0.1mol金属钠在过量氧气充分燃烧,生成的化合物中离子总数为0.15NA
C. 在0.2L 0.5mol/L AlCl3溶液中Al3+数目是Cl-数目的1/3
D. 5.6g铁粉在2.24L(标准状态)氯气中充分燃烧,失去的电子数为0.3NA
14. 在H2O2溶液中加入KI和H2SO4的混合溶液,迅速发生反应,放出大量气体,反应过程可表示如下:①H2O2+2KI+H2SO4=I2+K2SO4+2H2O;②H2O2+I2=2HIO;③H2O2+2HIO=I2+O2↑+2H2O。下列说法正确的是
A. H2O2在上述3个反应中均做氧化剂
B. H2O2氧化性强于HIO,还原性弱于I2
C. 上述过程中每生成1mol氧气,消耗1mol双氧水
D. 在反应后的溶液中加入淀粉,溶液呈现蓝色
13. 下列说法正确的是
A.形成离子键的阴阳离子间只存在静电吸引力
B.HF、HCL、HBr、HI的热稳定性和还原性从左到右依次减弱
C.第三周期非金属元素含氧酸的酸性从左到右依次增强
D.元素周期律是元素原子核外电子排布周期性变化的结果
12.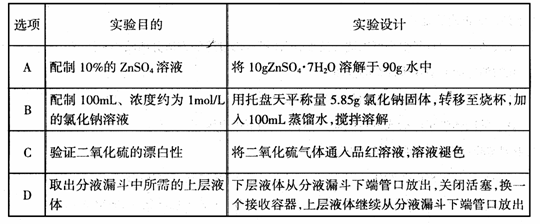 关于0.1mol/LNa2CO3溶液的叙述错误的是
关于0.1mol/LNa2CO3溶液的叙述错误的是
A. 0.5L该溶液中钠离子的物质的量浓度为0.2mol/L
B. 1L该溶液中含有Na2CO3的质量为10.6g
C. 从1L该溶液中取出100mL,则取出溶液中Na2CO3的物质的量浓度为0.01mol/L
D. 取该溶液10mL,加水稀释至100mL后,Na2CO3的物质的量浓度为0.01mol/L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com