
题目列表(包括答案和解析)
9.用标准盐酸滴定未知浓度的NaOH溶液时,若测定结果偏高,则产生误差的原因可能是
A.滴定时,装NaOH溶液的锥形瓶未用NaOH溶液润洗
B.酸式滴定管用蒸馏水洗后,用标准盐酸润洗
C.滴定前,酸式滴定管尖嘴处有气泡,而在滴定后气泡消失
D.滴定前仰视读取了酸式滴定管的读数,滴定后读数正确
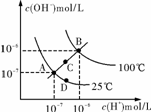
8.水的电离平衡曲线如图所示,下列说法不正确的是
A.图中四点Kw间的关系:A=D<C<B
B.若从A点到C点,可采用:温度不变在水中加入少量NaAc固体
C.若从A点到D点,可采用:温度不变在水中加入少量酸
D.若处在B点所在的温度,将pH=2的硫酸与pH=10的NaOH的两种溶液等体积混合后,溶液显中性
7.在下列各组反应中,两者反应遵循的化学原理相同的是
A.KClO3+6HClKCl+3Cl2↑+3H2O和2Na2S+3H2SO3===2Na2SO3+3S↓+3H2O
B.稀硫酸溶解FeO和稀硝酸溶解FeO
C.过氧化钠的漂白性和SO2水溶液的漂白性
D.泡沫灭火器灭火和干粉灭火器灭火
6.与pH类似,我们定义pOH=-lgc(OH-),下列溶液,一定呈中性的是
A.c(H+)=1×10-7mol·L-1的溶液
B.水电离的H+和OH-浓度相等的溶液
C.pH+pOH=14的溶液
D.pH=pOH的溶液
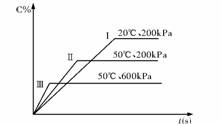
5.在密闭容器中进行以下可逆反应:A(g)+B(g)C(g)+2D(?),在不同的条件下C的百分含量的变化情况如右图,则该反应描述正确的是
A.正反应放热,D是固体
B.正反应放热,D是气体
C.正反应吸热,D是气体
D.正反应放热,D是固体或气体
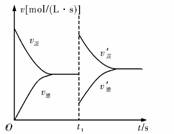
4.如图是关于N2+3H22NH3 ΔH<0的速率-时间图象,则t1时刻使平衡发生移动的原因是
A.升高温度,同时增大压强
B.降低温度,同时减小压强
C.增大反应物的浓度,同时使用适宜的催化剂
D.增大反应物的浓度,同时减小生成物的浓度
3.下列离子方程式正确的是
A.向溴化亚铁溶液中通入少量氯气:2Fe2++Cl2===2Fe3++2Cl-
B.苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O―→2C6H5OH+CO
C.向硫酸氢钠溶液中滴入氢氧化钡溶液至中性:H++SO+Ba2++OH-===BaSO4↓+H2O
D.将氢氧化铁粉末加入氢碘酸中:Fe(OH)3+3H+===Fe3++3H2O
2.化学中常用类比的方法可预测许多物质的性质。如根据H2+Cl2===2HCl推测:H2+Br2===2HBr。但类比是相对的,如根据2Na2O2+2CO2===2Na2CO3+O2,类推2Na2O2+2SO2===2Na2SO3+O2是错误的,应该是Na2O2+SO2===Na2SO4。下列各组类比中正确的是
A.由溶解性CaCO3<Ca(HCO3)2,推测:Na2CO3<NaHCO3
B.由CO2+Ca(ClO)2+H2O===CaCO3↓+2HClO,推测:SO2+Ca(ClO)2+H2O===CaSO3↓+2HClO
C.由2CO2+Ca(ClO)2+2H2O===Ca(HCO3)2+2HClO,推测:CO2+NaClO+H2O===NaHCO3+HClO
D.由Na2SO3+2HCl===2NaCl+H2O+SO2↑,推测:Na2SO3+2HNO3===2NaNO3+H2O+SO2↑
1.在一定温度下,反应A2(g)+B2(g)2AB(g)达到平衡的标志是
A.单位时间内生成nmol A2同时生成nmol的AB
B.容器内总压强不随时间而变化
C.v正(A)=2v逆(AB)
D.单位时间生成2mol AB同时生成了1mol A2
21.(9分)某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究。
(1)写出试管B中的实验现象 。
(2)写出A中反应的化学方程式: 。
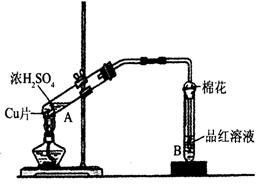 (3)充分反应后,若A试管中有铜片剩余,继续向A中加入
(3)充分反应后,若A试管中有铜片剩余,继续向A中加入
NaNO3,发现铜片溶解,反应的离子方程式为:
。
(4)如果将A中的反应设计成原电池,则原电池
负极发生的电极反应为 ,
(5)B试管口的棉花应沾有的试剂是 。
(6)小组成员向A中反应后的溶液中加入足量的氧化铜。
使剩余的硫酸全部转化为硫酸铜,过滤后,将滤液加热浓缩,冷却后结晶制得硫酸铜晶体(CuSO4·xH2O)。小组成员采用加热法测定该晶体里结晶水x的值。其中,在他们的实验操作中,至少称量四次,最后两次称量至恒重,确保结晶水晶体完全失去,下面是其中一次实验的数据:
|
坩埚质量 |
坩埚与晶体的总质量 |
最后一次加热后坩埚与固体总质量 |
|
11.0g |
37.8g |
27.0g |
根据上表数据计算判断x的实测值比理论值(x=5) (填“偏大”、“偏小”)。
2010-2011学年度福州三中高三年级12月月考化学试题
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com