
题目列表(包括答案和解析)
19.(10分)固体X是由两种常见元素组成的化合物,其中金属元素与另一元素的质量比为14∶1。在一定条件下X可发生如下框图的转化关系,有的反应标出全部产物,有的反应标出部分产物。已知P为两种气体的混合物,R是无色无味能使澄清石灰水变浑浊的气体,C为红褐色物质,M为常见金属单质,Q为常见非金属单质。试填空。
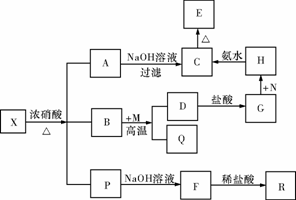
(1)X的化学式为 ,P中气体的化学式为 。
(2)实现G→H,欲不引进新的杂质,N可以选择下列物质中的 (填序号)。
①KMnO4 ②HNO3 ③H2O2 ④Cl2
(3)写出B和M反应的化学方程式: 。
(4)已知P中有一种气体与氢氧化钠溶液反应可生成两种正盐,该反应的离子方程式为 。
18.(8分)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题:
(1)煤的气化的主要化学反应方程式为: 。
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)  CH3OH(g) ΔH=-90.8kJ·mol-1
CH3OH(g) ΔH=-90.8kJ·mol-1
②2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-23.5kJ·mol-1
③CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=-41.3kJ·mol-1
CO2(g)+H2(g) ΔH=-41.3kJ·mol-1
写出水煤气直接合成二甲醚同时生成CO2的热化学反应方程式 。
(3)一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是 。
a.高温高压 b.低温低压
c.减少CO2的浓度 d.增加CO的浓度
e.分离出二甲醚 f.加入催化剂
(4)已知反应②2CH3OH(g)  CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
|
物质 |
CH3OH |
CH3OCH3 |
H2O |
|
浓度/(mol·L-1) |
0.44 |
0.6 |
0.6 |
比较此时正、逆反应速率的大小:v正 v逆(填“>”、“<”或“=”),若上述情况达到平衡,此时c(CH3OH)= 。
17.(8分)某班级同学查阅资料,对Na2S有了一定的认识,并提出了以下几个问题,请回答:
(1)1000℃时,在密闭容器中加入一定量的Na2SO4固体使其发生以下反应达到平衡:
Na2SO4(s)+4H2(g)  Na2S(s)+4H2O(g) ΔH>0若反应在恒温恒容状态下进行,回答以下问题:
Na2S(s)+4H2O(g) ΔH>0若反应在恒温恒容状态下进行,回答以下问题:
向容器中分别加入以下物质,判断对平衡有无影响,有影响的填写出平衡移动的方向。
①加入Na2SO4 。②加入焦炭 。
(2)向Na2S的浓溶液中逐滴加入稀盐酸,直到不再生成H2S气体为止,则在此过程中,溶液的c(HS-)变化趋势可能是 。
a.逐渐减小 b.逐渐增大
c.先逐渐增大,而后减小 d.先逐渐减小,而后增大
(3)Na2S溶液与下列溶液混合,不能发生反应的是 。
①H2S ②SO2 ③Na2SO3 ④酸性KMnO4溶液 ⑤CuSO4 ⑥氯水
(4)写出Na2S和AlCl3溶液反应的离子方程式 。
16.可逆反应A(g)+3B(g)
 2C(g);ΔH<0。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1mol A和3mol B,在一定条件下达到平衡时放出热量为Q1 kJ;在相同的条件下,向乙容器中加入2mol C达到平衡后吸收热量为Q2 kJ,已知Q1=3Q2。下列叙述不正确的是
2C(g);ΔH<0。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1mol A和3mol B,在一定条件下达到平衡时放出热量为Q1 kJ;在相同的条件下,向乙容器中加入2mol C达到平衡后吸收热量为Q2 kJ,已知Q1=3Q2。下列叙述不正确的是
A.平衡时甲中A的转化率为75%
B.平衡时甲中A的转化率和乙中C的转化率相同
C.达到平衡后,再向乙中加入0.25mol A、0.75mol B、1.5mol C,平衡向生成C的方向移动
D.乙中的热化学反应方程式为2C(g)  A(g)+3B(g);ΔH=+4Q2kJ/mol
A(g)+3B(g);ΔH=+4Q2kJ/mol
第Ⅱ卷 非选择题(共52分)
15.常温常压下,将amol CO2气体通入1L bmol·L-1的NaOH溶液中,下列对所得溶液的描述不正确的是
A.当a=1/2b时,所得溶液中存在:c(Na+)>c(CO)>c(OH-)>c(HCO)>c(H+)
B.当1/2b<a<b时,所得溶液中存在:c(Na+)>c(CO)+c(HCO)+c(H2CO3)
C.当a=b时,所得溶液中存在:c(OH-)+c(CO)=c(H+)+c(H2CO3)
D.当a=b时,所得溶液中存在:c(Na+)>c(CO)>c(HCO)>c(OH-)>c(H+)
14.重水(D2O)的离子积为1.6×10-15,可以用pH一样的定义来规定pD=-lgc(D+),以下关于pD的叙述正确的是
A.重水的pD=7.0
B.含0.01mol NaOD的D2O溶液1L,其pD=12.0
C.溶解0.01molDCl的D2O溶液10L,其pD=2.0
D.在100mL 0.25mol/L的DCl重水溶液中,加入50mL 0.2mol/L NaOD的重水溶液,其pD=1.0
13.在恒压密闭容器M(如图Ⅰ)和恒容密闭容器N(如图Ⅱ)中,分别加入amol X和amol Y,起始时两容器体积均为V L,发生如下反应并达到化学平衡状态:2X(?)+Y(?)  xZ(g) ΔH<0。平衡时M中X、Y、Z的物质的量之比为1∶3∶4。下列判断正确的是
xZ(g) ΔH<0。平衡时M中X、Y、Z的物质的量之比为1∶3∶4。下列判断正确的是
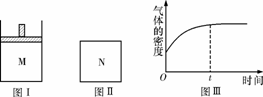
A. x=4
B.若N中气体的密度如图Ⅲ所示,则X、Y都是气态
C.若X为气体,Y为非气体,则平衡时M、N中Z的物质的量相等
D.若X、Y均为气体,平衡时M中X的转化率小于N中X的转化率
12.下列说法正确的是
A.物质的量浓度均为0.1mol·L-1的(NH4)2SO4、(NH4)2Fe(SO4)2两种溶液中,c(NH)相同
B.25℃时,在0.1mol·L-1的CH3COOH溶液中加入CH3COONa固体,溶液的pH一定小于7
C.25℃时,将0.1mol·L-1的NaOH溶液与pH=1的稀硫酸等体积混合,混合后的溶液pH=7
D.将同浓度的NaAlO2溶液与Na2CO3溶液混合后,可以生成白色沉淀,并产生气泡
11.在一固定容积的密闭容器中充入3mol A和1mol B,发生反应:3A(g)+B(g)xC(g),达到平衡后,C的体积分数为W%。若维持容器体积和温度不变,按0.9mol A、0.3mol B和2.1mol C为起始物质,达到平衡后,C的体积分数仍为W%,则x值可能为
A.1 B.2 C.3 D.任意值
10.下列说法正确的是
①pH=2和pH=1的H2SO4中c(H+)之比为1∶10
②0.2mol·L-1与0.1mol·L-1醋酸中,c(H+)之比大于2∶1
③纯水在80℃和20℃时,pH相等
④FeCl3溶液中c(Fe3+)与c(Cl-)之比为1∶3
⑤同温时,pH=10的Ba(OH)2溶液和pH=10的KCN溶液中由水电离的OH-浓度后者大
⑥100mL 0.1 mol·L-1的醋酸与10 mL 1.0 mol·L-1的醋酸中H+的数目,前者多
A.①④⑤ B.①⑤⑥
C.①②⑤ D.①②③⑥
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com