
题目列表(包括答案和解析)
14、在一密闭容器中,反应aA(g)  bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的40%,则下列说法正确的是 ( )
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的40%,则下列说法正确的是 ( )
A.平衡向正反应方向移动 B.物质A的转化率增大
C.物质B的质量分数增加 D.a>b
13、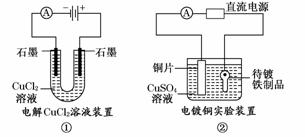 观察下列几个装置示意图,有关叙述正确的是
( )
观察下列几个装置示意图,有关叙述正确的是
( )
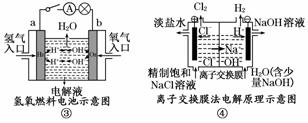
A.装置①中阳极上析出红色固体
B.装置②的待镀铁制品应与电源正极相连
C.装置③中外电路电子由a极流向b极
D.装置④的阳极反应为:2H++2e-→H2↑
12、关于氯化铁水解的说法错误的是 ( )
A.水解达到平衡(不饱和)时,无论加氯化铁饱和溶液还是加水稀释,平衡均向正方向移动
B.浓度为5 mol/L和0.5 mol/L的两种FeCl3溶液,其他条件相同时,Fe3+的水解程度前者比后者小
C.有50℃和20℃的同浓度的FeCl3溶液,其他条件相同时,Fe3+的水解程度前者比后者小
D.为抑制Fe3+水解,较好地保存FeCl3溶液,应加少量盐酸
11、若在铜片上镀银时,下列叙述正确的是( )
①将铜片接在电源的正极上 ②将银片接在电源的正极上 ③在铜上发生的反应是:Ag++e-→ Ag ④在银片上发生的反应是:4OH-→ O2↑+2H2O+4e- ⑤需用硫酸铜溶液为电镀液 ⑥需用硝酸银溶液为电镀液
A、①③⑥ B、②③⑥ C、①④⑤ D、②③④⑥
10、下列关于电解法精炼粗铜的叙述中不正确的是( )
A、精铜板作阳极,纯铜片作阴极,CuSO4溶液作电解液
B、电解时,阳极发生氧化反应,而阴极发生的反应为: Cu2+ +2e-→Cu
C、粗铜中所含Ni、Fe、Zn等金属杂质,电解后以单质形式沉积槽底,形成阳极泥
D、电解铜的纯度可达99.95%-99.98%
9、如图装置分别通电一段时间后,溶液的质量增加的是 ( )

8、在一定温度下,下列叙述不是可逆反应A(g)+3B(g)
 2C(g)达到平衡的标志的是
2C(g)达到平衡的标志的是
(1)C的生成速率与C的分解速率相等;(2)单位时间内amol A生成,同时生成3amol B;(3)A、B、C的浓度不再变化;(4)体积不变得密闭容器中混合气体的总压强不再变化;(5)混合气体的物质的量不再变化;(6)单位时间消耗amol A,同时生成3amol B; (7)A 、B、C的分子数目比为1:3:2。
A.(2)(5) B.(1)(3) C.(2)(7) D.(5)(6)
7、下列说法正确的是 ( )
A.焓变和熵变都大于0的反应肯定是自发的
B.焓变小于0而熵变大于0的反应肯定是自发的
C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
D.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向
6、2008年10月8日,瑞典皇家科学院宣布美籍华裔科学家钱永健获得2008年度诺贝尔化学奖.少年时代,他就对化学产生了浓厚的兴趣.16岁时,他凭借一个金属易受硫氰酸盐腐蚀的调查项目,荣获具有“少年诺贝尔奖”之称的著名奖项.下列说法正确的是( )
A.金属腐蚀就是金属失去电子被还原的过程
B.将水库中的水闸(钢板)与外加直接电源的负极相连,正极连接到一块废铁上可防止水闸被腐蚀
C.由原电池原理知所有的合金都比纯金属更易被腐蚀
D.铜板上的铁铆钉处在潮湿的空气中发生:Fe→Fe3++3e-,从而形成铁锈,但此过程铜不被腐蚀
5、纽扣电池的两极材料为锌和氧化银,电解质溶液为KOH溶液。放电时两个电极反应分别为:Zn+2OH-→Zn(OH)2+2e- Ag2O+H2O+2e-→2Ag+2OH- 下列说法中正确的是( )
A.锌是正极,氧化银是负极 B.锌发生还原反应,氧化银发生氧化反应。
C.溶液中OH-向正极移动,K+、H+向负极移动。
D.在电池放电的过程中,电解质溶液的酸碱性基本保持不变。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com