
题目列表(包括答案和解析)
2. 实验室里不宜长期放置,应在使用时才配制的试剂是 ( )
①酚酞试液 ②银氨溶液 ③Na2CO3溶液 ④Cu(OH)2悬浊液
⑤酸性FeCl3溶液 ⑥FeSO4溶液 ⑦NaCl溶液 ⑧氯水
A. ②⑤⑥⑧ B. ①③④⑤ C. ①②⑤⑦ D. ②④⑥⑧
1. 2009年4月22日是第40个世界地球日,这年世界地球日的主题是“绿色世纪”。下列行为不符合这一主题的是 ( )
A. 分类回收、利用垃圾,减少资源浪费
B. 推广使用一次性木筷,减少疾病传染yjw
C. 开发风能等洁净能源,减少使用化石燃料
D. 研究煤和石油脱硫新技术,减少酸雨发生
(二)
(1) 。
(2) mol。
(3)① , 。
②___ __。
“华安、连城、永安、漳平一中,龙海二中,泉港一中”六校联考
(一)
(1) 。
(2) 。
16.(12分)
I.(1)_ ,
。
(2) 。
Ⅱ.
(1) 。
(2) , _____________。
17.(14分)
(1)① ; ② , ;③ 。
(2)① ; ② , 。
18.(12分)
(1) , 。
(2)① , 。
② 。
③ 。ks*5u
19.(17分)
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
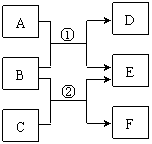
(二)若A、C、E是氢化物,构成B和F的元素是第三周期的相邻元素,F是一种淡黄色固体,A能使湿润的红色石蕊试纸变蓝,A、E混合时有白烟生成。
(1)写出D的分子式 。
(2)由A或C转化为E,每消耗1molB,转移电子的物质的量为 mol。
(3)同温同压下,将V 1L A气体和V 2L E气体通入水中,
①若V1=V2,反应后溶液的pH_____7(填“>”或“<”或“=”),原因是
(用离子方程式表示)。
②若所得溶液的pH=7,则V1_____V2(填“>”或“<”或“=”)。
 “华安、连城、永安、漳平一中,龙海二中,泉港一中”六校联考
“华安、连城、永安、漳平一中,龙海二中,泉港一中”六校联考
2010-2011学年上学期第三次月考高三化学答题卷
(一)若A、C、E是氧化物,构成B、D的元素在同一主族,反应①②都是工业上的重要反应,通过反应②可以实现煤的气化,使煤变为清洁能源。
(1)写出反应①的化学方程式 。ks*5u
(2)用化学方程式表示E在冶金工业上的一种重要用途 。
16.(12分)H2O2是实验室常用的一种化学试剂。
I.某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
|
实验编号 |
反应物 |
催化剂 |
|
① |
10mL2% H2O2溶液 |
无 |
|
② |
10mL5% H2O2溶液 |
无 |
|
③ |
10mL5% H2O2溶液 |
1mL0.1mol·L-1FeCl3溶液 |
|
④ |
10mL5%
H2O2溶液+少量HCl溶液 |
1mL0.1mol·L-1FeCl3溶液 |
|
⑤ |
10mL5%
H2O2溶液+少量NaOH溶液 |
1mL0.1mol·L-1FeCl3溶液 |
 (1)实验①和②的目的是_
,实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是
。
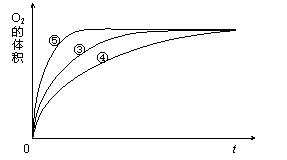
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如右图。
(1)实验①和②的目的是_
,实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是
。
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如右图。
分析上图能够得出的实验结论是
。
Ⅱ.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学设计了如右图所示的实验装置进行实验。
(1)实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略,则实验中需要测量的数据是 。
 (2)加入0.1g mol
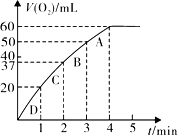
MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。ks*5u
(2)加入0.1g mol
MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。ks*5u
解释反应速率变化的原因 ,计算H2O2的初始物质的量浓度___________。(保留两位有效数字)
17.(14分)

 温室气体二氧化碳减排的一种方法是:从燃煤电厂或天然气电厂排放气中回收CO2,再与CH4热解炉产生的H2反应生成CH3OH。
温室气体二氧化碳减排的一种方法是:从燃煤电厂或天然气电厂排放气中回收CO2,再与CH4热解炉产生的H2反应生成CH3OH。
CO2(g)+3H2(g) CH3OH(g)+H2O(g)
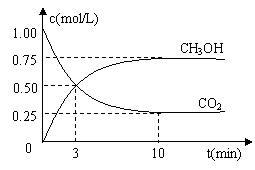
(1)500℃时,在体积为1 L的容积固定的密闭容器中,充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
① 从反应开始到平衡,氢气的平均反应速率v(H2)=___________mol·L-1·min-1。
② 该反应的平衡常数K= (保留一位小数),平衡时H2的转化率为 。
③ 已知温度升高,K值减小。下列措施中能使n(CH3OH)/n(CO2)增大的是 。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
(2)CH3OH作为内燃机燃料或通过燃料电池驱动车辆。可减少CO2排放多达45%。
① 已知:
CH3OH(g)+H2O(g)===CO2(g)+3H2(g) △H1=+49.0 kJ·mol-1 2H2(g)+ O2(g)===2H2O(g) △H =-483.6kJ·mol-1
 则反应CH3OH(g)+
则反应CH3OH(g)+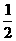 O2(g)===CO2(g)+2H2(g)的 △H = kJ·mol-1。
O2(g)===CO2(g)+2H2(g)的 △H = kJ·mol-1。
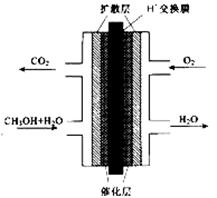
② 甲醇质子交换膜燃料电池的结构示意图如下,已知H+移向通入O2的电极,甲醇进入 极(填“正”或“负”),正极发生的电极反应为 。
18.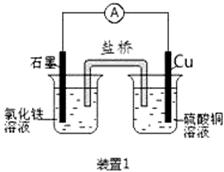
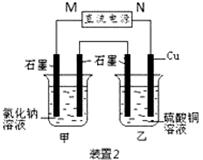 (12分)如图所示2套实验装置,分别回答下列问题。
(12分)如图所示2套实验装置,分别回答下列问题。
(1)装置1中的Cu是 极(填“正”或“负”),该装置发生的总反应的离子方程式为 。ks*5u (2)装置2中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到右边石墨电极附近首先变红,左边石墨电极附近无明显现象。 ① 电源的M端为 极,甲烧杯右边石墨电极附近首先变红的原因是 。 ② 乙烧杯中电解反应的离子方程式为 。 ③ 若装置甲阴、阳两极各产生112mL气体(标准状况),则装置乙所得溶液的pH为 (忽略反应前后溶液的体积变化)。
19. (17分)
(17分)
A-F是中学常见物质,其中B、D、F均为单质,它们的相互转化关系如下图所示:
15.已知H2(g)+Br2(l)=2HBr(g);△H=-72 kJ·mol-1,蒸发1molBr2(l)需要吸收的能量为30KJ,其他的相关数据如下表,则表中a为 ( )
|
|
H2(g) |
Br2(g) |
HBr(g) |
|
1mol分子中的化学键断裂时需要吸收的能量/kJ |
436 |
a |
369 |
A.200 B.260 C.230 D.404
第Ⅱ卷 非选择题(共55分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com