
题目列表(包括答案和解析)
8.在KI和KIO3混合溶液中通入H2S发生反应后,只生成碘、硫酸钾和水,在此反应中被氧化的碘元素与被还原的碘元素的物质的量之比为( )
A.5:1 B.6:1 C.1:1 D.1:5
7.A、B、C、D、E是核电荷数依次增大的短周期元素,原子半径按D、E、B、C、A的顺序减小,B和E同主族,下列推断不正确的是 ( )
A.A、B、E一定在不同周期 B.D为第二周期
C.A、D可能在同一主族 D.C和D的单质可能化合为离子化合物
6.用水热法制备Fe3O4纳米颗粒的总反应如下:
3Fe2++ 2S2O32-+O2+4OH-= Fe3O4 + S4O62-+2H2O。下列说法正确的是( )
A.在反应中1molO2氧化了3mol Fe2+
B.还原剂是Fe2+,氧化剂是S2O32-和O2
C.每生成1mol Fe3O4,转移3mol电子
D.当转移1mol电子时,消耗56g S2O32-
5.阿伏加德罗常数约为6.02×1023mol-1,下列说法中正确的是 ( )
A.1L 1mol·L-1 CH3COOH溶液中,CH3COOH分子数约为6.02×1023
B.1molCl2与一定量的Fe刚好完全反应电子转移数约等于3×6.02×1023
C.在含4mol硅氧键的水晶晶体中,氧原子数目为2×6.02×1023yjw
D.用铁作电极电解饱和K2SO4溶液时,当阴极产生的气体体积为2.24L时,阳极产物的物质的量一定为0.05×6.02×1023
4.下列离子方程式正确的是 ( )
A.碳酸氢钠溶液与少量石灰水反应 HCO3-+ Ca2+ + OH- = CaCO3↓ + H2O
B.铁溶于稀硝酸,溶液变黄: Fe+4H++ NO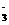 ===
Fe3++ NO↑+2H2O
===
Fe3++ NO↑+2H2O
C.Na2CO3溶液显碱性:CO2-3+H2O=== HCO-3+OH-
D.已知稀溶液中,酸碱反应的中和热为57.3KJ/mol,则将浓度均为0.1mol/l的NaOH溶液与醋酸等体积混合时的热化学方程式为:
NaOH(aq)+CH3COOH(aq)===CH3COONa(aq)+H2O(l);△H=-57.3kJ/mol
3. 下列与化学反应能量变化相关的叙述正确的是 ( )
A.生成物总能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率yjw
C.应用热化学方程有关计算规律,可计算某些难以直接测量的反应焓变
D.同温同压下,H2(g)+Cl2(g) 2HCl(g)在光照和点燃条件下的△H不同
2.下列有关化学研究的正确说法是 ( )
A.同时改变两个变量来研究反应速率的变化,能更快得出有关规律
B.对于同一个化学反应,无论是一步完成还是分几步完成,其反应热是相同的
C.依据丁达尔效应可将分散系分为溶液、胶体与浊液
D.从HF、HCI、HBr、HI酸性递增的事实,可推出F、Cl、Br、I的非金属性递增的规律
1.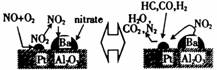 诺贝尔化学奖获得者Gerhard
Ertl在表面化学研究领域取得了开拓性成就。某反应在Pt/Al2O3/Ba催化剂表面吸附与解吸作用的机理如图所示(图中HC表示碳氢化合物,nitrate指硝酸盐),该机理研究是指( )
诺贝尔化学奖获得者Gerhard
Ertl在表面化学研究领域取得了开拓性成就。某反应在Pt/Al2O3/Ba催化剂表面吸附与解吸作用的机理如图所示(图中HC表示碳氢化合物,nitrate指硝酸盐),该机理研究是指( )
A. 汽车尾气催化转化机理
B. 钢铁生锈机理
C. 合成氨工业催化机理
D. 氢氧燃烧电池电极反应机理
24.(11分)芳香酯类化合物A、B互为同分异构体,均含C、H、O三种元素。相同状况下A、B蒸汽对氢气的相对密度都是97,分子中C、H原子个数相同,且C、H原子总数是氧原子数的5倍。
已知:各有机物之间存在如下转化关系

其中C能发生银镜反应,F经连续氧化可生成C;C与D是相对分子质量相同的不同类有机物。
(1)A的分子式是 。
(2)E中所含官能团的名称是 。
(3)B的结构简式是 。
水杨酸与小苏打反应的化学方程式是 。
C与F反应的化学方程式是 ,反应类型是 。
(4)同时符合下列要求的同分异构体有 种。
①与A互为同分异构体 ②可以水解 ③苯环上有两个取代基,且苯环上的一氯
23.(8分)工业合成氨与制备硝酸一般可连续生产,流程如下:
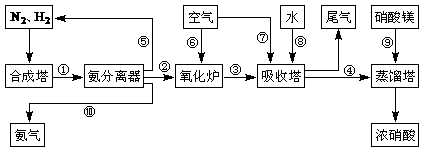
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g) CO2+H2
CO2+H2
t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_____(填计算结果)。
|
T/K |
T1 |
573 |
T2 |
|
K |
1.00×107 |
2.45×105 |
1.88×103 |
(2)合成塔中发生反应N2(g)+3H2(g) 2NH3(g);△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中
2NH3(g);△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中
T1____573K(填“>”、“<”或“=”)。
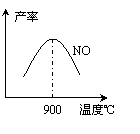 (3)NH3和O2在铂系催化剂作用下从145℃就开始反应:
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:
4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H=-905kJ·mol-1
4NO(g)+6H2O(g) △H=-905kJ·mol-1
不同温度下NO产率如图所示。温度高于900℃时,
NO产率下降的原因 。
(4)硝酸厂的尾气含有氮氧化物,如果不经处理直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g); △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g); △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:_____________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com