
题目列表(包括答案和解析)
19.(1) (2)① ;
② ; ;
③ ④
26.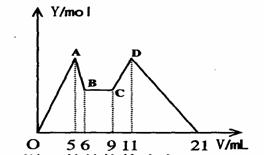 (7分)某溶液含 Mg2+、Al3+,向其中滴加a mLC1mol·L-1NaOH之后,改成滴加C2mol·L-1H2SO4溶液,所得沉淀Y(mol)与所加试剂总体积V(mL)间的关系如右图所示。据此,回答下列问题:
(7分)某溶液含 Mg2+、Al3+,向其中滴加a mLC1mol·L-1NaOH之后,改成滴加C2mol·L-1H2SO4溶液,所得沉淀Y(mol)与所加试剂总体积V(mL)间的关系如右图所示。据此,回答下列问题:
(1)C-D过程中的离子方程式 ;
(2)n(Mg2+)/ n(Al3+) = ;
(3)C1/C2= ;
(4)所加入NaOH溶液的体积a= mL。
可能用到的原子量:H-1 C-12 N-14 O-16 Na-23 S-32 P-31 Mg-24 Al-27 Cl-35.5 K-39 Fe-56
25.(7分)科学家对H2O2结构的认识经历了较为漫长的过程,最初,科学家提出了两种观点: ①H-O-O-H、②
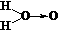 。式中O→O表示配位键,即共用电子对由某原子单方面提供(已知在化学反应中氧氧键遇到还原剂时易断裂)。
。式中O→O表示配位键,即共用电子对由某原子单方面提供(已知在化学反应中氧氧键遇到还原剂时易断裂)。
化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:
a.将C2H5OH与浓H2SO4反应,生成(C2H5)2SO4和水;
b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;
c.将生成的A与H2反应(已知该反应中H2作还原剂)。
(1)用电子式表示①、②两种结构:①_________________、②________________。
(2)如果H2O2的结构如①所示,实验c中化学反应方程式为(A写结构简式,下同)___________________________________________________________________;假如H2O2的结构如②所示,实验c中化学反应方程式为
___________________________________________________________________。
(3)为了进一步确定H2O2的结构,还需要在实验c后添加一步实验d,请设计d的实验方案:___________________________________________________________。
24.(7分)某无色溶液X,由Na+、Ag+、Ba2+、Al3+、AlO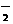 、MnO
、MnO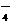 、CO
、CO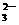 、SO
、SO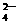 中的若干种离子组成,取溶液进行如下连续实验:
中的若干种离子组成,取溶液进行如下连续实验:
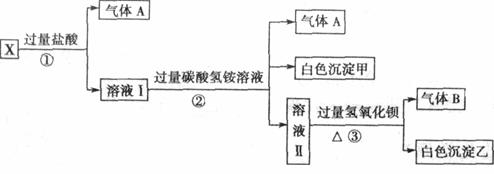
(1)白色沉淀甲是 _________。
(2)X溶液中一定存在的离子是_____________。
(3)白色沉淀乙中一定有:______ ,可能有 证明其是否存在的方法是 。
(4)若将过量的气体A与适量的气体B通入水中,写出反应的离子方程式
23.(6分)化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。下图为N2(g)和O2(g)生成NO(g)过程中的能量变化
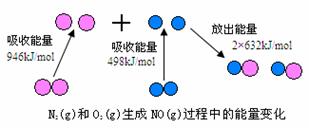
(1)人们通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,则N≡N的键能为___________ kJ/mol,由上图写出N2(g)和O2(g)生成NO(g)的热化学反应方程式_______________________
(2)1840年,俄国化学家盖斯在分析了许多化学反应热效应的基础上,总结出一条规律:“一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的。”这个规律被称为盖斯定律。有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。
①根据下列反应的热化学反应式,计算由C(石墨)和H2(g)反应生成1mol C2H2(g)的△H。
C(石墨) + O2(g) = CO2(g);△H1 = - 393.5 kJ/mol
2H2(g) + O2(g) = 2H2O(l);△H2 = - 571.6 kJ/mol
2C2H2(g) + 5 O2(g) = 4CO2(g) + 2H2O(l);△H3 = - 2599.2 kJ/mol,则由C(石墨)和H2(g)反应生成1mol C2H2(g)的△H _______________________ kJ/mol。
②已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知单质碳的燃烧热为Y kJ/mol,则1mol C与O2反应生成CO的反应热△H为_________
22.(6分)(1)钇(Y)是激光材料和超导材料中的重要元素。其钇矿石成分是Be2YxFeSi2O10。该矿石与过量烧碱共熔后,加水溶解,所得沉淀中有Y(OH)3和Fe2O3(已知在空气中熔化时矿石中只有Fe由+2价变成+3价),则x等于 ,若改用氧化物的形式表示其组成,则化学式为 。
(2)把SO2通入Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时若滴入BaCl2溶液,则会产生白色沉淀。在上述变化过程中
溶液由棕黄色变为浅绿色用离子方程式表示为 ,后又由浅绿色变为棕黄色的离子方程式为 。
21.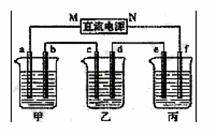 (8分)下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的HCl溶液、CuSO4溶液和K2SO4溶液,电极均为石墨电极。
(8分)下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的HCl溶液、CuSO4溶液和K2SO4溶液,电极均为石墨电极。
(1)接通电源后,观察到甲中b电极上产生刺激性气味气体。据此回答问题:
① 电源的N端为 极;
② 电极c上的现象为_____________________________;
③ 电极f上的电极反应式为 ;
④ 乙中加入_______________________,可使其恢复至原溶液。
(2)若丙中盛装19g质量分数为10%的K2SO4溶液,当电极b上产生的刺激性气味气体在标准状况下的体积为11.2L时,则丙中质量分数变为: ;(过程中无晶体析出)
(3)如果乙装置电解过程中铜全部析出,此时电解能否继续进行,_______________。为什么? 。
20.(8分) 已知①-④均为工业生产及应用的常见反应。其中常温下B、D、J、P气体,E为分子中原子个数比为1∶l的液体。A的相对分子质量为120。M的焰色反应为黄色。(个别反应的产物已略去)
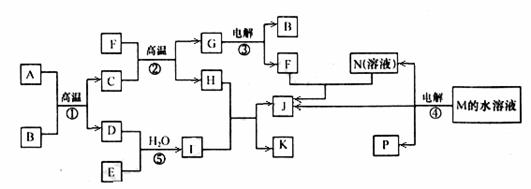
试回答下列问题:
(1) 反应F与N溶液反应的离子方程式为_____________________________________;
(2)  反应⑤中当有1mol电子转移时,(3) 氧化剂消耗
g。
反应⑤中当有1mol电子转移时,(3) 氧化剂消耗
g。
(4) 反应④的离子方程式为______________________________;
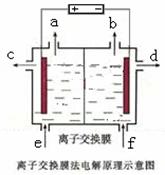
右图是该反应原理的示意图,该装置中使用的是 (填“阴”或“阳”)离子交换膜。图中从d处收集到的是 。
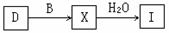 (5) 工业上由D制取I的过程可表示为:
(5) 工业上由D制取I的过程可表示为:
由D与B反应生成X的反应所用的设备是
①高炉 ②沸腾炉 ③接触室 ④分馏塔 ⑤吸收塔
1.原子核对核外电子的吸引力 2.形成稳定结构的倾向
下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1):
|
|
锂 |
X |
Y |
|
失去第一个电子 |
519 |
502 |
580 |
|
失去第二个电子 |
7296 |
4570 |
1820 |
|
失去第三个电子 |
11799 |
6920 |
2750 |
|
失去第四个电子 |
|
9550 |
11600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量。 。
②表中X可能为以上13种元素中的 (填写字母)元素。用电子式表示X和j形成的化合物 。
③Y是周期表中 族元素。
④以上13种元素中, (填写字母)元素原子失去核外第一个电子需要的能量最多。
19.(6分)下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
|
b |
|
|
|||||||||||||||
|
|
|
|
|
h |
|
j |
|
|
|||||||||
|
a |
c |
f |
|
i |
|
l |
m |
||||||||||
|
|
|
|
e |
|
|
|
|
|
|
|
|
|
g |
|
|
|
|
|
|
d |
|
|
|
|
|
|
|
|
|
|
|
|
|
k |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)下列 (填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、1 ④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com