
题目列表(包括答案和解析)
4.钢铁在潮湿的空气中会形成原电池而被腐蚀,下列说法正确的是
A.钢铁设备上连接铜块可以防止腐蚀
B.原电池的正极反应为:o2+2H20+4e一叫0H-
C.原电池的负极反应为:Fe---,Fe3++3e-
D.钢铁与外加直流电源的正极相连可以防止腐蚀 ’ .
3.短周期元素X、Y、Z在元素周期表中的位置如下图所示,下列说法正确的是
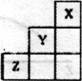
A.X、Y、z三种元素中,Y的非金属性最强
B.Y的气态氢化物的稳定性比Z的弱
C.Y的原子半径在同周期元素中最大
D.X单质的熔点比2单质的熔点高
2.下列分类正确的是
A.同位素:1H、D+、T2
B.电解质:H20、CH3COOH、NH4HC03
C.胶体:饱和氯化铁溶液、淀粉溶液、牛奶
D.硅酸盐产品:水晶、水泥、陶瓷
1.下列叙述正确的是
A.“雨后彩虹”是一种自然现象,;与胶体的知识有关
B.“农夫山泉”纯净水不含任何化学成分
C.“通风橱”是一种负责任的防污染手段,可使有害气体得到转化或吸收
D.长期盛放NaOH溶液的滴瓶不易打开,是因为NaOH与瓶中的C02反应使瓶内气体减少形成“负压”之故
23.[化学--选修有机化学基础](15分)
已知A、B、C、D、E、F六种有机物存在如下转化关系, E分子中有三种不同的氢原子,
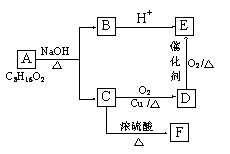 且其个数比为6:1:1,F能使Br2的CCl4溶液褪色。
且其个数比为6:1:1,F能使Br2的CCl4溶液褪色。
请回答下列问题:
(1)C和E的官能团名称:C ,E 。
(2)由F生成高聚物的化学方程式 。
(3)六种有机物中能跟Na反应的是 (填字母)。
(4)由A生成B和C的化学反应方程式为 。
(5)D在一定条件下生成C的化学反应方程式为 。

|

|
 版权所有:()
版权所有:()
版权所有:()
版权所有:()
 2010-2011学年度第一学期锦州市普通高中期末考试
2010-2011学年度第一学期锦州市普通高中期末考试
23.[化学-选修物质结构与性质](15分)
X、Y、Z、Q、E、F六种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L
层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z
的核电荷数之和,E在第二周期主族元素中电负性最大的元素。请回答下列问题:
(1)XZ2与YZ2分子的立体结构分别是 和 ,相同条件下两者在水中的溶解度较大的
是 (写分子式),理由是 ;
(2)Q的元素符号是 ,它的核外电子排布式为 ,在形成化合物时它的最高化合价为 ;
(3)用氢键表示式写出E的氢化物溶液中存在的所有氢键 。
(4)F的氢化物是一种碱性气体, F还可与氢形成离子化合物FH5,其电子式为 。
F还可与氢形成离子化合物FH5,其电子式为 。
23.[化学-选修化学与技术](15分)
(15分)空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:源网]
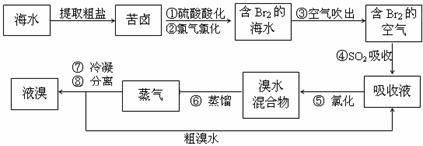
(1)溴在周期表中位于 周期 族。
(2)步骤①中用硫酸酸化可提高Cl2的利用率,理由是 。
(3)步骤④利用了SO2的还原性,反应的离子方程式为 。
(4)步骤⑥的蒸馏过程中,温度应控制在80-90℃。温度过高或过低都不利于生产 ,请解释原因 。
(5)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是 。
(6)步骤①、②之后并未直接用“含Br2的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氯化”后再蒸馏,这样操作的意义是____。
22.(12分)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)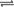 C0(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
C0(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是 。
a.容器中压强不变 b.混合气体中c(CO)不变 c.v正(H2)= v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
选考题:请考生从以下三道题中选做一道,如果多做,按所做的第一题计分。
21.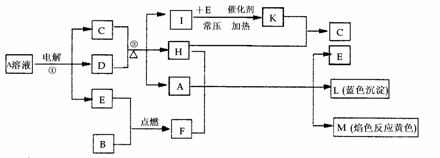 (16分)已知B是常见的金属单质,E为常见的气态非金属单质,H常温下为无色液体,C的浓溶液在加热时才与D反应。根据下列框图所示,试回答:
(16分)已知B是常见的金属单质,E为常见的气态非金属单质,H常温下为无色液体,C的浓溶液在加热时才与D反应。根据下列框图所示,试回答:
(1)L的化学式为 ;F的电子式为 ,所含化学键为 ;
(2)反应①的离子方程式为 ;该反应前后溶液的pH (填:“变大”;“变小”;“不变”);
(3)每生成1 mol K,反应放出98.3 kJ的热量,该反应的热化学方程式为 ;
(4)反应②的化学方程式为 ;
(5)化合物F与Na2S溶液反应,生成NaOH和S单质,试写出该反应的离子方程式为 。
20.(6分)已知甲、乙、丙分别代表中学化学中的常见物质,若甲的化学式为RCl3,
其溶液在加热蒸干并灼烧 时可发生反应: a.甲+H2O
时可发生反应: a.甲+H2O 乙+丙 b.乙
乙+丙 b.乙 氧化物+H2O
氧化物+H2O
请根据 题目要求回答下列问题:
题目要求回答下列问题:
(1)若 甲为某用途广泛的金属元素的氯化物,其溶液在上述变化中生成的氧化物为红棕色粉末,则该金属在周期
甲为某用途广泛的金属元素的氯化物,其溶液在上述变化中生成的氧化物为红棕色粉末,则该金属在周期 表中的位置是 。
表中的位置是 。
(2)若甲为某短周期金属元素的氯化物,则甲发生a反应的化学方程式为 。
(3)将以上两种金属单质用导线连接,插入一个盛有NaOH溶液的烧杯中构成原电池,则负极发生的电极反应为 _。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com