
题目列表(包括答案和解析)
2.某学生的实验报告中有下列数据:①用托盘天平称取11.7g氯化钠;②用100mL的量筒量取21.48mL盐酸;③用容量瓶配制216mL 1mol/L的氯化钠溶液;④用酸式滴定管量
取25.00mL硫酸溶液;⑤用pH试纸测定H2SO4溶液的pH为3.2。其中合理的是
A.只有②④ B.只有①④ C.只有①③ D.只有②⑤
1. 在一支25 mL的酸式滴定管中盛入0.1 mol/L HCl溶液,其液面恰好在5 mL的刻度处。若把滴定管中的溶液全部放入烧杯中,然后以0.1 mol/L NaOH溶液进行中和,则所需NaOH溶液的体积
A.大于20 mL B.小于20 mL C.等于20 mL D.等于5 mL
21.(12分) 下图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。
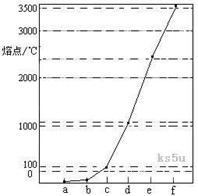
(1)请写出上图中d单质对应元素原子的电子排布式 。
(2)单质a、f对应的元素以原子个数比1 :1形成的分子(相同条件下对H2的相对密度为13)中含 个 键和 个
键和 个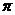 键。
键。
(3)a与b的元素形成的10电子中性分子X的空间构型为 ;将X溶于水后的溶液滴入到AgNO3溶液中至过量,得到络离子的化学式为 ,其中X与Ag+之间以 键结合。
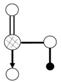 (4)右图是上述六种元素中的一种元素形成的含氧酸的结构:请简要说明该物质易溶于水的两个数原因
。
(4)右图是上述六种元素中的一种元素形成的含氧酸的结构:请简要说明该物质易溶于水的两个数原因
。
20.(10分)草酸(H2C2O4)是一种重要的化工原料。已知常温下0.01 mol·L-l的H2C2O4、KHC2O4、K2C2O4溶液的pH如下表所示。
|
|
H2C2O4 |
KHC2O4 |
K2C2O4 |
|
pH |
2.0 |
3.1 |
8.1 、 |
(1)在其它条件不变时,下列措施能使KHC2O4溶液中c(K+):c(HC2O4-)接近1:1的是_________(填字母)。
A.加入适量的H2C2O4 B.加入适量的KHC2O4
C.加入适量的Na2C2O4 D.升高溶液的温度
(2)取一定质量H2C2O4·2H2O和KHC2O4的混合物,加水溶解,配成250 mL溶液,取两份此溶液各25 mL,向第一份溶液中先加入几滴酚酞试液,再滴加0.25 mol·L-l NaOH溶液至20.00 mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3 mol·L-l H2S04溶液酸化后,用0.10 mol·L-l KMnO4溶液滴定,当消耗KMnO4溶液16.00 mL时,溶液由无色变为浅紫红色。请回答下列问题:

①完成离子方程式:5C2O42-+2MnO4-+16H+ =10______+2Mn2++8H2O。
②原混合物中H2C2O4·2H2O和KHC2O4的物质的量之比为__________。
(3)某实验小组用如图所示的装置探究FeC2O4·2H2O在隔绝空气条件下受热分解的产物。当36.0g FeC2O4·2H2O充分反应后,残留固体质量为13.6g,浓硫酸增重7.2g,碱石灰增重11.0g。求残留固体的成分和物质的量。(已知FeC2O4·2H2O的相对分子质量为180;设反应产生的气体被充分吸收)
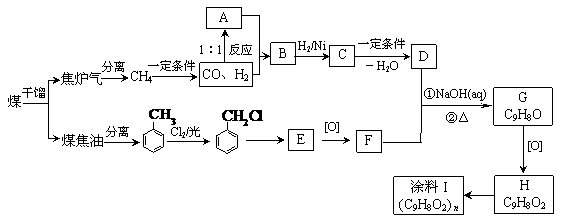
19.(14分)以煤为原料可合成重要化工中间体G,其中B与乙酸互为同分异构体,也能与钠反应放出氢气(注:下列图示流程中某些反应条件不一定给出)。
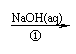 已知:① CH3CHO + CH3CHO
CH3CH=CHCHO
已知:① CH3CHO + CH3CHO
CH3CH=CHCHO
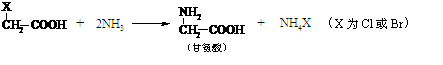 ②
②
试填空。
(1)C的结构简式是: 。
(2)B→C所属反应的基本类型是: H分子内含氧官能团名称 。
(3)涂料I的链接是: 。
(4)F + D → G的化学方程式为: 。
(5)能与Na2CO3溶液反应的E的芳香族化合物的同分异构体有 种。
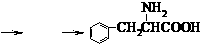
(6)写出H …… 的合成路线并注明反应条件。
18.(12分)下图是工业生产硝酸铵的流程。
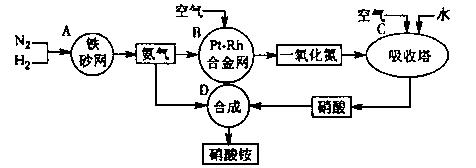
(1)吸收塔C中通入空气的目的是 。
A、B、C、D四个容器中的反应,属于氧化还原反应的是 (填字母)。
(2)已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H= -1266.8kJ/mol
N2(g)+O2(g)=2NO(g) △H=+180.5 kJ/mol
写出氨高温催化氧化的热化学方程式: ,
氨催化氧化反应的化学平衡常数表达式K= 。
(3)已知:N2(g)+3H2(g)  2NH3(g) △H=一92
kJ/mol。为提高氢气的转化率,宜采取的措施有
。(填字母)
2NH3(g) △H=一92
kJ/mol。为提高氢气的转化率,宜采取的措施有
。(填字母)
A.升高温度 B.使用催化剂 C.增大压强
D.循环利用和不断补充氮气 E.及时移出氨
(4)在一定温度和压强下,将H2和N2按3:1(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为33.33%,此时H2的转化率为 。
17.(10分)因“召回门”而闹的沸沸扬扬的丰田Prius属第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮。汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态。
(1)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,每生成1 mol水蒸气放热569.1 kJ。则该反应的热化学方程式为_________________________________。
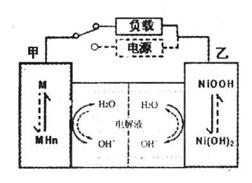 (2)混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解液。镍氢电池充放电原理示意如图,
(2)混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解液。镍氢电池充放电原理示意如图,
其总反应式是:

根据所给信息判断,混合动力车下坡或刹车时,甲电极的电极反应式为_______;混合动力车上坡或加速时,乙电极的电极反应式为_________________。
(3)汽车尾气中的一氧化碳是大气污染物,可通过如下反应降低其浓度: CO(g)+1/2O2(g)  CO2(g)。
CO2(g)。
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示。请填写表中的空格。
|
容器编号 |
c(CO)/mo1·L-1 |
c (O2)/mol·L-1 |
c (CO2)/mol·L-1 |
v(正)和v (逆) 比较 |
|
I |
2.0×10-4 |
4.0×10-4 |
4.0×10-2 |
v(正)=v(逆) |
|
Ⅱ |
3.0×10-4 |
4.0×10-4 |
8.0×10-2 |
|
②相同温度下,某汽车尾气中CO、CO2的浓度分别为1.0×10-5mol·L-l和1.0×10-4mol·L-l。若在汽车的排气管上增加一个补燃器,不断补充O2并使其浓度保持为1.0×10-4mol·L-1,则最终尾气中CO的浓度为_________mol·L-1。
16.(12分)氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料, 防腐等工业。该物质露置于空气中易被氧化为绿色的高价铜盐,在热水中易水解生成氧化铜水合物而呈红色。已知pH为5时,+2价铜已开始以碱式盐的形式沉淀。某兴趣小组去一家回收含铜电缆废料的工厂做社会调查,技术人员向他们展示了处理废料的综合利用方案:
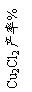
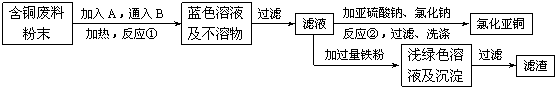

⑴ 加入的A是 ,通入的B是 。
⑵ 反应②的离子方程式是 。
为提高Cu2Cl2的产率,常在反应②的溶液中加入
适量稀碱溶液,控制pH为3.5。这样做的目
的是 。
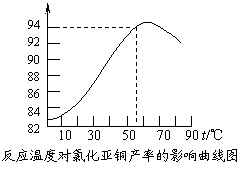
⑶ 保持各反应物的最佳配比,改变温度,测得
Cu2Cl2产率的变化如下图所示。则溶液温度控
制在 时,Cu2Cl2的产率已达到94%,
当温度高于65℃时,Cu2Cl2产率会下降,其原
因可能是 。
15.(8分)已知SO2、SiO2、CO2等氧化物化学物质具有一定的相似性。用下图所示装置进行Mg与SO2反应的实验。
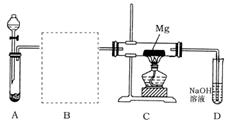
(1)选择制取SO2的合适试剂 (填编号);
①20%的HNO3溶液②80%的H2SO4溶液③Na2SO3固体④CaSO3固体
(2)在方框中画出B的装置图并注明试剂;
(3)实验后对C装置玻璃管中的固体成分进行分析,未检测到单质硫,则Mg与SO2反应的产物除MgO外另一种是 (填化学式),请用实验加以证明 。
14.某同学设计如下实验测量m g铜银合金样品中铜的质量分数:

下列说法中不正确的是 ( )
A.收集到的V L气体全为 NO
B.过滤用到的玻璃仪器是:烧杯、漏斗、玻璃棒
C.操作Ⅱ应是洗涤
D.铜的质量分数为: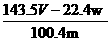 ×100%
×100%
非选择题(78分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com