
题目列表(包括答案和解析)
5.下列金属或氧化物可以完全溶解的是 ( )
A.1molZn与含1molHCl的稀盐酸供热
B.1molCu与含2molH2SO4的浓硫酸共热
C.1molCu与含4molHNO3的浓硝酸供热
D.1molMnO2与含4molHCl的浓盐酸共热
4.工业上由SiCl4制备高纯硅时,不使用钠、镁等活泼金属做还原剂,而是用氢气作还原剂其原因是 ( )
A.钠或镁等活泼金属的价格昂贵,成本高
B.钠或镁等活泼金属的还原性不及氢气强
C.钠或镁等金属可能与硅形成合金或残留在硅中
D.钠或镁的熔点没有硅高
3.科学家提出硅是“21世纪的能源”,这主要是由于作为半导体材料的硅在太阳能发电过程中具有重要的作用。下列关于硅的说法中正确的是 ( )
A.地壳中硅的含量稀少
B.自然界中存在大量单质硅
C.高纯度的硅被用于制作计算机芯片
D.光导纤维的主要成分是Si
2.下列说法中错误的是 ( )
A.二氧化硫能漂白某些物质,说明它具有氧化性
B.二氧化硫的水溶液中滴加氯化钡无现象,再加入0.5mL3%的过氧化氢后产生沉淀
C.将足量二氧化硫通入酸性高锰酸钾溶液中,溶液褪色,说明二氧化硫具有还原性
D.二氧化硫漂白过的草帽过一段时间后又会恢复到原来的颜色
1.以下说法正确的是 ( )
A.纳米材料是指一种称为“纳米”的新物质制成的材料
B.绿色食品是指不含任何化学物质的食品
C.生物固氮是指植物通过叶面直接吸收空气中的氮气
D.光导纤维是以二氧化硅为主要原料制成的
23、将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:
(1)NO的体积和NO2的体积各约为多少升?
(2)待产生的气体全部释放后,向溶液中加入V mL a mol/L 的NaOH溶液,恰好使溶液中的 Cu2+全部转化成沉淀,则原硝酸溶液的物质的量浓度为多少?
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水多少克?
解:
|
[方案一]
称取一定质量样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。
(1)坩埚中发生反应的化学方程式为:___________________________________。
(2)实验中,需加热至恒重的目的是:
。
[方案二]
称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤、干燥沉淀,称量固体质量,计算。
(1)过滤操作中,除了玻璃棒、漏斗外,还要用到的玻璃仪器为 。
(2)实验中判断沉淀是否完全的方法是
。
[方案三]
按如下图所示装置进行实验:
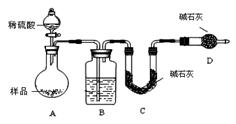
 (1)D装置的作用是
。
(1)D装置的作用是
。
分液漏斗中 (填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(2)实验前称取17.90g样品,实验后测得C装置增重 8.80g,则样品中NaHCO3的质量分数为 。
(3)根据此实验测得的数据,测定结果有误差,因为实验装置还存在一个明显缺陷是:
。
21、(10分)氢氧化镁用于制药工业,还是重要的绿色阻燃剂。
Ⅰ、治疗胃酸过多药物Stmoache的有效成分为Mg(OH)2。
(1)该药物治疗胃酸(主要成分为盐酸)过多症时反应的离子方程式是:______
____________________________________________。
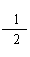 Ⅱ、已知:Mg(s) + 2H2O(g) == Mg(OH)2(s)
+H2(g) △H1==-441 kJ/mol
Ⅱ、已知:Mg(s) + 2H2O(g) == Mg(OH)2(s)
+H2(g) △H1==-441 kJ/mol
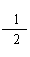 H2O(g) == H2(g) + O2(g) △H2==+242kJ/mol
H2O(g) == H2(g) + O2(g) △H2==+242kJ/mol
Mg(s) + O2(g)== MgO(s) △H3==-602kJ/mol
(2)氢氧化镁分解的热化学方程式是:__________________________________。
(3)氢氧化镁可以作为阻燃剂的原因(写一条即可):_____________________
_____________________________________________________________。
Ⅲ、某工厂用六水合氯化镁和粗石灰制取的氢氧化镁含有少量氢氧化铁杂质,通过如下流程进行提纯精制,获得阻燃剂氢氧化镁。
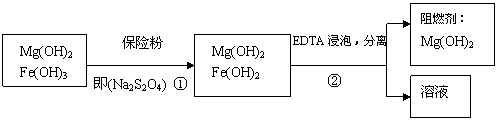
(4)步骤②中分离操作的名称是:__________________________。
(5)步骤①中的反应如下:6 Fe(OH)3 + S2O42-+2OH-==6 Fe(OH)2 +2SO42-+4H2O。
每消耗0.1 mol保险粉(Na2S2O4)时,转移电子的数目是________________NA。
20、(10分)短周期元素A、B、C、D、E的原子序数依次增大,A与C、B与D分别同主族。A与E能形成化学式为AE型的共价化合物,C与D能形成化学式为C2D型的离子化合物。
⑴ A、B、C三种元素组成的化合物的化学式为_________________。由B与C组成的一种化合物与水发生反应的化学方程式为__________________________________________。
⑵ C的单质在B的单质中燃烧,生成物中含有的化学键有_____________________。
⑶ 钢铁与C2DB4的水溶液接触时,会构成许多微小原电池,而发生钢铁的______
_____________腐蚀(填“吸氧”或“析氢”)。若用惰性电极电解熔融状态的化合物CE时,阳极的电极反应式为___________________________________。
⑷ 与C同周期的某金属元素的单质,溶于由A、B、C三种元素组成的化合物的水溶液时,发生反应的离子方程式为__________________________________________________。
19.(5分)
Ⅰ、建筑工地常用的NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应:

 NaNO2 +
NaNO2 + 
 HI
HI 


 NO +
NO + 
 I2 +
I2 + 
 NaI +
NaI + 
 H2O
H2O
(1)配平并标出电子转移的方向和数目。
(2)上述反应的氧化剂是 ;
Ⅱ、 叠氮酸钠(NaN3)是抗禽流感药物“达菲”合成过程中的中间活性物质。
NaN3中存在的化学键有____________(答案可能不止一个)
a、离子键 b、极性共价键 c、非极性共价键
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com