
题目列表(包括答案和解析)
20、 (1)已知: O2
(g) = O2+(g) + e-
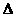 H1= 1175.7 kJ·mol-1
H1= 1175.7 kJ·mol-1
PtF6(g) + e-
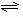 PtF6-(g)
PtF6-(g)
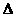 H2= - 771.1 kJ·mol-1
H2= - 771.1 kJ·mol-1
O2 + PtF6-(s) = O2+(g) + PtF6- (g)  H3 = 482.2 kJ·mol-1
H3 = 482.2 kJ·mol-1
则反应O2(g)+
PtF6 (g) = O2 + PtF6- (s)的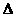 H=_____________
H=_____________
(2)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)
=0.030mol·L-1、c(N2O4)=0.0120mol·L-1。计算反应2NO2(g) N2O4
(g)
N2O4
(g)
的平衡常数K=_____________________
19.难挥发性二硫化钽(TaS2 )可采用如下装置提纯。将不纯的TaS2 粉末装入石英管一
端,抽真空后加入适量碘并封管,置于加热炉中。反应如下:
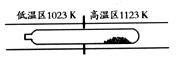 TaS2 ( s)+2I2 (g)
TaS2 ( s)+2I2 (g) TaI4 (g)+S2 (g)
TaI4 (g)+S2 (g)
下列说法正确的是( )
A.在不同温度区域,TaI4 的量保持不变
B. 在提纯过程中,I2 的量不断减少
C.在提纯过程中,I2 的作用是将TaS2 从高温区转移到低温区
D. 该反应的平衡常数与TaI4 和S2 的浓度乘积成反比
第Ⅱ卷 (非选择题共52分)
18.下列与化学反应能量变化相关的叙述正确的是( )
A.生成物总能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.应用盖斯定律,可计算某些难以直接测量的反应焓变
D.同温同压下,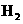 (g)+
(g)+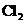 (g)==== 2HCl(g)在光照和点燃条件下的△H不同
(g)==== 2HCl(g)在光照和点燃条件下的△H不同
17.下列反应的离子方程式不正确的是( )
A.盐酸加入氨水:H+ + NH3·H2O = NH4+ + H2O
B.铜片插入硝酸银溶液:Cu + 2Ag+ Cu2+ + 2Ag
C.碳酸钙加入醋酸:CO32-+2CH3COOH CO2↑+2CH3COO-+H2O
D. 少量CI2通入到FeI2中:2I- + CI2 = I2 + 2CI-
16. Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:
 2Li++FeS+2e- Li2S+Fe 有关该电池的下列中,正确的是(
)
2Li++FeS+2e- Li2S+Fe 有关该电池的下列中,正确的是(
)
A. Li-Al在电池中作为负极材料,该材料中Li的化合价为+1价
B. 该电池的电池反应式为:2Li + FeS = Li2S + Fe
C.
 负极的电极反应式为 Al
Al3+ + 3e-
负极的电极反应式为 Al
Al3+ + 3e-
D.
 充电时,阴极发生的电极反应式为:Li2S+Fe 2Li+ +
FeS + 2e-
充电时,阴极发生的电极反应式为:Li2S+Fe 2Li+ +
FeS + 2e-
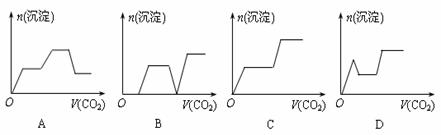
15、将足量的CO2不断通入KOH、Ba(OH)2、K[Al(OH)4]混合溶液中,生成沉淀与通入CO2的体积的关系可表示为( )
14.已知I-、Fe2+、SO2、Cl-、H2O2在酸性溶液中的还原性强弱顺序为:
SO2>I->H2O2>Fe2+>Cl-,则下列反应不可能发生的是 ( )
A. 2 I-+2Fe3+=I2+2Fe2+ B.H2O2+H2SO4=SO2+O2+2H2O
C.2Fe3+ +SO2+2H2O=2Fe2++SO42-+4H+ D.SO2+2H2O+I2=H2SO4+2HI
13、用铜片、银片、Cu (NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U
型管)构成一个原电池。以下有关该原电池的叙述正确的是( )
 ①在外电路中,电流由铜电极流向银电极
①在外电路中,电流由铜电极流向银电极  ②正极反应为:Ag+ + e- Ag
②正极反应为:Ag+ + e- Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A. ①② B.②③ C.②④ D.③④
12.室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列错误的是:( )
A.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
B.此酸的电离平衡常数约为1×10-7mol/L
C.该溶液的pH=4
D.升高温度,溶液的pH增大
11.下列说法正确的是 ( )
A.pH=2与pH=1的硝酸中c(H+)之比为1:10
B.Na2CO3溶液中c( Na+)与c(CO32-)之比为2:1
C.0.2mol/L与0.1mol/L醋酸中c(H+)之比为2:1
D.NO2溶于水时,被氧化的n(NO2)与被还原的n(NO2)之比为3:1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com