
题目列表(包括答案和解析)
6.下列判断正确的是( )
A.25℃时,浓度均为0.1 mol·L-1的CH3COOH、CH3COONa等体积混合,溶液呈酸性:c(CH3COO-)+ c(OH-)<c(CH3COOH)+ c(H+)
B.相同条件下,2mol氯原子所具有的能量小于1mol氯分子所具有的能量
C.0.1 mol/L的碳酸钠溶液的pH大于0.1 mol/L的醋酸钠溶液的pH
D.pH=2的一元酸和pH=12的一元强碱等体积混合:c(H+)==c(OH¯)
5. 下列离子方程式正确的是( )
A.NH4HCO3溶液中加入过量稀NaOH溶液:NH4++ OH-=NH3·H2O
B.FeBr2溶液中通入足量的氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
C.硫酸亚铁溶液中加入用硫酸酸化的双氧水 Fe2++2H++H2O2=Fe3++2H2O
D.在通入过量SO2后的NaOH溶液中加足量的溴水(不考虑SO2的溶解):
HSO3-+Br2+H2O=3H++2Br-+SO42-
4.用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
A.2L 1mol·L-1 (NH4)2SO4溶液中含有4NA个铵根离子
B.0.1mol铜与足量硫磺充分反应,转移的电子数为0.2 NA
C.某温度下,1L pH=6的纯水中,含1.0×10-6NA个OH-
D.一定条件下用含1mol FeCl3的溶液制备Fe(OH)3胶体,产生NA个Fe(OH)3胶粒
3.化学在生产和日常生活中有着重要的应用。下列说法不正确的是( )
A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B. 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
C. MgO的熔点很高,可用于制作耐高温材料
D. 电解MgCl2饱和溶液,可制得金属镁
2.化学与生产、生活、社会密切相关。下列有关说法中不正确的是( )
A.2009年12月在哥本哈根召开的国际气候会议受到全球政要的广泛关注。减缓工业生产大量二氧化硫的排放以抑制全球气候变暖成为该会议的主题
B.针对目前甲型H1N1流感的扩散情况,要加强对环境、个人的消毒预防。其中消毒剂常选用含氯消毒剂、酒精、双氧水等适宜的物质
C.2009年诺贝尔物理学奖授予华裔科学家高锟,是因其在光纤材料领域取得了卓越贡献。光纤的主要成分与玛瑙相同,通常情况下不与强氧化剂和强酸反应
D.建国60周年庆典晚会上,天安门广场燃放的焰火是某些金属元素魅力的展现
1.“混盐”是指一种金属离子与多种酸根离子构成的盐,如CaOCl2就是一种混盐。“复盐”是指含有多种简单阳离子和一种酸根阴离子的盐如KAl(SO4)2,下列各化合物中属于混盐的是( )
A . Ca(NO3)Cl B.(NH4)2Fe(SO4)2 C.Mg7(OH)6(CO3)4 D. K3[Fe(CN)6]
24、某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:
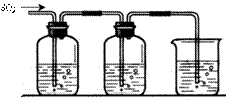
FeCl3溶液 含有淀粉的碘水 NaOH溶液
A B C
(1)SO2气体还原Fe3+的反应产物是___________________(填离子符号),参加该反应的SO2和Fe3+的物质的量之比是____________。
(2)下列实验方案适用于在实验室制取所需SO2的是____________(填序号)。
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热浓H2SO4
(3)装置C的作用是_____________________________________________。
(4)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、自然干燥,在这一系列操作中没有用到的仪器有____________(填序号)。
A.蒸发皿 B.石棉网 C.漏斗 D.烧杯 E.玻璃棒 F.坩埚
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案②:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是________,原因是__________________________。
(6)能表明I-的还原性弱于SO2的现象是____________________________。
2010-2011学年度济阳一中高三模块检测(2010年12月)
23.(12分)对金属制品进行抗腐蚀处理,可延长其使用寿命。
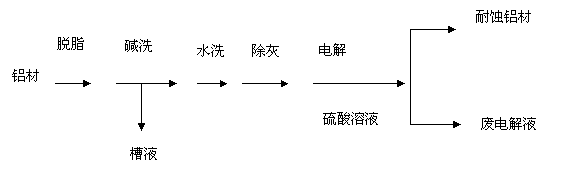 (1)以下为铝材表面处理的一种方法:
(1)以下为铝材表面处理的一种方法:
①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是______(用离子方程式表示)。为将碱洗槽液中铝以沉淀形式回收,最好向槽液中加入下列试剂中的______.。
a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,在H2SO4 溶液中电解,铝材表面形成氧化膜,阳极电极反应式为____。取少量废电解液,加入NaHCO3,溶液后产生气泡和白色沉淀,产生沉淀的原因是_____
______________________________。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是______________
 ________________________________。
________________________________。
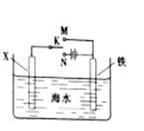
(3)利用右图装置,可以模拟铁的电化学防护。
若X为碳棒,为减缓铁的腐蚀,开关K应置于_____________处。
若X为锌,开关K置于M处,该电化学防护法称为_____________。
(4)以H2为燃料可制成氢氧燃料电池。已知 2H2(g)+O2(g)===2H2O(l)
△H=-572KJ.mol-1 某氢氧燃料电池释放228.8KJ电能时,生成1mol液态水,该电池的能量转化率为 ___________________________ 。
22、J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置 如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。K^S*5U.C#O
(1)M的离子结构示意图为______________;
元素T在周期表中位置_________________________________
(2)L的最简单气态氢化物甲的水溶液显碱性。
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2 的清除剂,所发生反应的产物不污染环境,其化学方程式为____________________________。
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是_______(选填序号)。
|
选项 |
a |
b |
c |
d |
|
x |
温度 |
温度 |
加入H2的物质的量 |
加入甲的物质的量 |
|
y |
甲的物质的量 |
平衡常数K |
甲的转化率 |
生成物物质的量总和 |
(3)由J、R形成的液态化合物JR2 0.2mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kj。 该反应的热化学方程式为_______________________。
(4)试叙述由R元素所对应的最高价含氧酸根离子的检验方法: 。
21、 高炉炼铁过程中发生的主要反应为
高炉炼铁过程中发生的主要反应为
 1/3Fe203(s)+
CO(g)
2/3 Fe(s)+CO2(g)
1/3Fe203(s)+
CO(g)
2/3 Fe(s)+CO2(g)
 已知该反应在不同温度下的平衡常数如表所示:
已知该反应在不同温度下的平衡常数如表所示:
请回答下列问题:
(1)该反应的平衡常数表达式:_________,△H___0(填“大于”、“小于”或“等于”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10 min后达到平衡。求该时间范围内反应的平均反应速率v (C02)= _____________________,CO的平衡转化率= _____________:
(3)欲提高(2)中CO的平衡转化率,可采取的措施是_____________。
A.减少Fe的量 B.增加Fe203的量 C.移出部分C02
D.提高反应温度 E.减小容器的容积 F.加入合适的催化剂
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com