
题目列表(包括答案和解析)
16.亚氨基锂(Li2NH)是一种储氢容量器,安全性好的固体储氢材料,其储氢原理可表示为Li2NH+H2=LiNH2+LiH。下列有关说法正确的是( )
A. Li2NH中N的化合价是-1 B.该反应中H2既是氧化剂又是还原剂
C.Li+和H-的离子半径相等 D.此法储氢和钢瓶储氢的原理相同
15.M和N两溶液分别含有下列十二种离子中的五种和七种离子:K+、Na+、H+、
NH4+、Fe3+、A13+、Cl-、OH-、NO3-、S2-、CO32-、SO42-。己知两溶液所含离子各不相同,M溶液里的阳离子只有两种,则N溶液里的阴离子应该是( )
A.OH-、CO32-、SO42- B.S2-、Cl-、SO42-
C.CO32-、NO3-、S2- D.Cl-、SO42-、NO3-
14.现有一定量的铁粉和铜粉的混合物,将其平均分成四等份,分别加入同浓度不同体积的稀硝酸,充分反应后,在标准状况下生成NO的体积和剩余金属的质量如下表(假设硝酸的还原产物只有NO一种):
|
编号 |
① |
② |
③ |
④ |
|
稀硝酸体积/mL |
100 |
200 |
300 |
400 |
|
剩余金属/g |
18.0 |
9.6 |
0 |
0 |
|
NO体积/mL |
2240 |
4480 |
6720 |
V |
根据上表中的数据计算分析,下列推断正确的是( )
A.①中溶解了5.6 g Fe B.②中溶解了9.6 g Cu
C.硝酸的浓度为4 mol/L D.④中V = 6720
13. 下列分子结构中,原子的最外层电子能都满足8电子稳定结构的是 ( )
A.CH4 B.PF3 C.SF6 D.BeCl2
12.常温时,下列溶液的pH或微粒的物质的量浓度关系正确的是( )
A.某溶液中由水电离出的c(H+)=1×10-amol·L-1,若a>7时,则该溶液pH一定为
14-a
B.等体积、等物质的量浓度的Na2CO3溶液与NaHCO3溶液混合:
2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3)
C.将0.2mol·L-1的某一元酸HA溶液和0.1mol·L-1NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:2c(OH-)+c(A-)=c(H+)+c(HA)
D.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于
7,则反应后的混合液:2c(R2-)+c(HR-)>c(Na+)
11.向硫酸铜溶液中通入足量NH3后可得到深蓝色溶液[溶质为Cu(NH3)4SO4],再向所得溶液通入SO2至溶液呈微酸性发现有白色沉淀Q生成,反应方程式为:①2Cu(NH3)4SO4+3SO2+4H2O=2NH4CuSO3↓+3(NH4)2SO4。再将Q与足量的10mol/L硫酸混合微热,则会发生如下反应:②2NH4CuSO3+2H2SO4=Cu+(NH4)2SO4+2SO2+CuSO4+2H2O。下面有关分析中正确的是( )
A.①是非氧化还原反应,而②是氧化还原反应
B.上述反应中SO2的作用只相当于催化剂
C.反应②中CuSO4是氧化产物
D.反应①中SO2发生还原反应
10. 已知在pH为4-5的环境中,Cu2+、Fe2+几乎不水解,而Fe3+几乎完全水解。工业上制CuCl2是将浓盐酸用蒸气加热到80℃左右,再慢慢加入粗氧化铜(含少量杂质FeO),充分搅拌使之溶解。欲除去溶液中的杂质离子,下述方法中可行的是( )
A. 加入纯Cu将Fe2+还原为Fe
B. 向溶液中通入H2S使Fe2+沉淀
C. 向溶液中通入Cl2,再通入NH3,调节pH值为4-5
D. 向溶液中通入Cl2,再加入纯净的CuO粉末调节pH值为4-5
9.对水的电离平衡不产生影响的粒子是( )
A.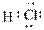 B.26M3+
C.
B.26M3+
C.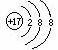 D.
D.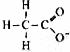
8.干燥剂的干燥性能可用干燥效率(1m3空气中实际余留水蒸气的质量)来衡量。某些干燥剂的干燥效率数据如下:
|
物 质 |
MgO |
CaO |
ZnCl2 |
ZnBr2 |
|
干燥效率 |
0.008 |
0.2 |
0.8 |
1.1 |
根据以上数据,下列有关叙述错误的是( )
A.MgO的干燥性能比CaO好
B.干燥效率可能与干燥剂的阴、阳离子的半径大小有关
C.MgCl2可能是比CaCl2更好的干燥剂
D.上述干燥剂中阳离子对干燥性能的影响比阴离子小
7. 用一定量的铁与足量的稀H2SO4及足量的CuO制单质铜,有人设计以下两种方案:
①Fe  H2
H2  Cu, ②CuO
Cu, ②CuO  CuSO4
CuSO4 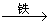 Cu。
Cu。
若实验过程中,根据一般的实验方法和实验操作规则进行操作,则两者制得单质铜的量作比较正确的是( )
A.相等 B.①多 C.②多 D.无法判断
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com