
题目列表(包括答案和解析)
7.核黄素又称为维生素B2,可促进发育和细胞再生,有利于增进视力,减轻眼睛疲劳。核黄素分子的结构为: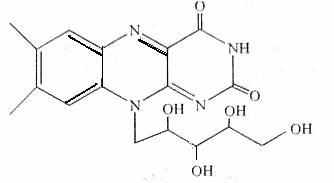
已知: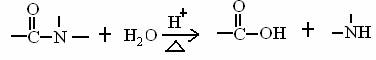
有关核黄素的下列说法中,不正确的是: ( )
A.该化合物的分子式为C17H22N4O6
B.酸性条件下加热水解,有CO2生成
C.酸性条件下加热水解,所得溶液加碱后有NH3生成
D.能发生酯化反应
6.亚氨基羟(Li2NH)是一种储氢容量器,安全性好的固体储氢材料,其储氢原理可表示为Li2NH+H2=LiNH2+LiH。下列有关说法正确的是 ( )
A. Li2NH中N的化合价是-1 B.该反应中H2既是氧化剂又是还原剂
C.Li+和H+的离子半径相等 D.此法储氢和钢瓶储氢的原理相同
5. 将甲烷、乙醇等物质在氧气中燃烧时的化学能直接转化为电能的装置叫燃料电池。燃料电池的基本组成为电极、电解质、燃料和氧化剂。此种电池的能量利用率可高达80%(一般柴油发电机只有40%左右),产物污染也少。下列有关燃料电池的说法错误的是 ( )
A.上述燃料电池的负极反应物是氢气、甲烷、乙醇等物质
B.氢氧燃料电池常用于航天飞行器,原因之一是该电池的产物为水,经过处理之后可供宇航员使用
C.乙醇燃料电池的电解质常用KOH,该电池的负极反应为C2H5OH-12e-===2CO2↑+3H2O
D.甲烷燃料电池的正极反应为O2+2H2O+4e-===4OH-
4. 某溶液中含有两种溶质NaCl和H2SO4,它们的物质的量之比为3∶1,用石墨做电极电解溶液时,根据电极产物,可明显分为三个阶段。下列叙述不正确的是 ( )
A.阴极只析出H2 B.阳极先析出Cl2,后析出O2
C.电解最后阶段为电解水 D.溶液pH不断增大,最后为7
3. 在100mL混合溶液中,HNO3和H2SO4物质的量浓度分别为0.4mol/L和0.1mol/L,向该溶液中加入1.92g铜粉,加热,待充分反应后,所得溶液中Cu2+物质的量浓度(mol/L)为 ( )
A.0.15 B.0.20 C.0.225 D.0.45
2. 短周期金属元素甲~戊在元素周期表中的相对位置如下表所示,下面判断正确的是
|
甲 |
乙 |
|
|
丙 |
丁 |
戊 |
A.原子半径: 丙<丁<戊
B.金属性:甲>丙
C.氢氧化物碱性:丙>丁>戊
D.最外层电子数:甲>乙
1. NA表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,22.4L二氯甲烷的分子数约为NA个
B.1.7g H2O2中含有的电子数为0.9 NA
C.1mol Na2O2 固体中含离子总数为4 NA .
D.电解精炼铜时,若阴极得到电子数为2NA个,则阳极质量减少64g
29.(18分)
(1)室温时氢氧化钙的溶度积KSP =4.7×10-6, 室温时将9 mL0.02 mol·L-1的氯化钙溶液与1 mL
pH=13的氢氧化钠溶液混合后(溶液体积可直接加和),溶液中 沉淀析出(填有或无).
(2)2.24升(标准状态)氨气通入250mL 浓度为0.1 mol·L-1的硫酸溶液中,充分反应后溶液中各离子浓度大小为 (按由大到小的顺序写出各离子符号)
 (3) 人体血液含Ca2+。现抽取某人血样10 mL,稀释后用草酸铵[(NH4)2C2O4]溶液处理,使Ca2+完全转变为草酸钙(CaC2O4)沉淀;过滤,洗涤,将得到的沉淀用稀硫酸溶解得到草酸(H2C2O4)溶液,用5.0×10-3 mol·L-1 KMnO4溶液滴定得到的草酸至终点,共耗去2.0 mL KMnO4溶液。由上述实验数据可求得此人血液中Ca2+的物质的量浓度为
.(提示:2 KMnO4 + 5H2C2O4 + 3H2SO4
= 2MnSO4 + K2SO4 + 10CO2↑+8H2O)
(3) 人体血液含Ca2+。现抽取某人血样10 mL,稀释后用草酸铵[(NH4)2C2O4]溶液处理,使Ca2+完全转变为草酸钙(CaC2O4)沉淀;过滤,洗涤,将得到的沉淀用稀硫酸溶解得到草酸(H2C2O4)溶液,用5.0×10-3 mol·L-1 KMnO4溶液滴定得到的草酸至终点,共耗去2.0 mL KMnO4溶液。由上述实验数据可求得此人血液中Ca2+的物质的量浓度为
.(提示:2 KMnO4 + 5H2C2O4 + 3H2SO4
= 2MnSO4 + K2SO4 + 10CO2↑+8H2O)
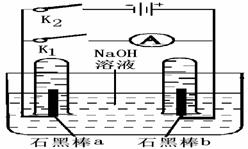
(4)用右图完成相应实验.
①断开K1,闭合K2接通直流电源,写出阳极
的电极反应 .
电解的总反应方程式
②电解一段时间后,当两石墨棒均有气体包
围时,切断K2闭合K1,发现电路中有电流通
过. 写出a极的电极反应式
28.(20分)(1)下图中A为淡黄色固体,B、C为溶液,D为气体,E、F为白色沉淀。
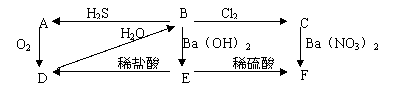 ①写出B→C的化学方程式
①写出B→C的化学方程式
②写出B→A的化学方程式
③C→F的离子方程式
④E→D的离子方程式
⑤上图中共发生了8个反应(每根箭头一个反应),其中有 个是氧化还原反应;从上图出现的物质中选出反应物,写出一个置换反应,以验证氯元素原子的氧化性比硫元素原子的氧化性强
 (2)把某黑色固体单质A加热至红热,投入到一种无色溶液B中,产生由两种气体组成的混合气体X ,将X做如下图所示的实验:
(2)把某黑色固体单质A加热至红热,投入到一种无色溶液B中,产生由两种气体组成的混合气体X ,将X做如下图所示的实验:
①由此可以推断:A为 ;C为 和
②写出D加入F生成E和G的离子方程式
③C通入澄清石灰水时,若气体通过量则白色沉淀又会溶解,写出白色沉淀溶解的化学方程式
27.(17分)氨是氮循环中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)已知:H-H键能为436 kJ·mol-1,N≡N键能为946 kJ·mol-1,N-H键能为391 kJ·mol-1。写出合成氨反应的热化学方程式:
(2)恒温下,往一个4L的密闭容器中充人5.2molH2和2molN2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
|
时间/min |
5 |
10 |
15 |
20 |
25 |
30 |
|
c(NH3)/mol·L-1 |
0.08 |
0.14 |
0.18 |
0.20 |
0.20 |
0.20 |
①5min内,消耗H2的平均反应速率为___________________________________
②N2的平衡转化率
③此条件下该反应的化学平衡常数K=__________________________。反应达到平衡后,若维持容器体积不变,温度不变,往平衡体系中加入H2、N2和NH3各8mol,化学平衡将向_______方向移动(填“正反应”或“逆反应”)。
④若维持容器体积不变,只升高温度化学平衡常数值 (填变大、变小、不变),正反应速率 (填变大、变小、不变)。
⑤若温度维持不变,只将容器体积由4L变为2L,达新平衡时N2的平衡浓度 0.4 mol·L-1(填大于、小与、等于)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com