
题目列表(包括答案和解析)
13.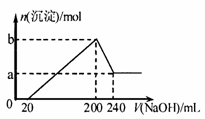 将一定质量的镁和铝混合物投入200 mL硫酸中,
将一定质量的镁和铝混合物投入200 mL硫酸中,
固体全部溶解后,放出一定体积H2,向所得溶液中
加入5 mol·L-1的NaOH溶液,生成沉淀的物质的
量n与加入NaOH溶液的体积V的变化如右图所
示。则下列说法不正确的是
A.a mol沉淀是Mg(OH) 2且a=0.15
B.最初20 mL NaOH溶液用于中和过量的硫酸
C.硫酸的物质的量浓度为2.5 mol·L-1
D.因为镁铝的质量未知,无法计算氢气的体积
II卷
12.已知:101 kPa时辛烷的燃烧热为5518 kJ·mol-1;强酸与强碱在稀溶液中发生反应时的中和热为57.3 kJ·mol-1;则下列热化学方程式书写正确的是
①C8H18(1)+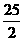 O2(g)
O2(g) 8CO2(g)+9H2O(1);△H=+5518 kJ·mol-1
8CO2(g)+9H2O(1);△H=+5518 kJ·mol-1
②C8H18(1)+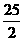 O2(g)
O2(g) 8CO2(g)+9H2O(1);△H=-5518 kJ·mol-1
8CO2(g)+9H2O(1);△H=-5518 kJ·mol-1
③H++OH- H2O;△H=-57.3 kJ·mol-1
H2O;△H=-57.3 kJ·mol-1
④NaOH(aq)+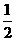 H2SO4(aq)
H2SO4(aq) Na2SO4(aq)+H2O(1);△H=+57.3 kJ·mol-1
Na2SO4(aq)+H2O(1);△H=+57.3 kJ·mol-1
A.①③ B.②③ C.②④ D.只有②
11.下图所示装置中,甲、乙、丙三个烧杯依次分别盛放NaOH溶液、AgNO,溶液和K2SO4溶液,电极均为石墨电极。接通电源,经过一段时间后乙中c电极质量增加。若电解过程中共有0.04 mol电子通过,则下列叙述中不正确的是
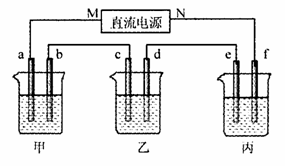
A.电源的N端为正极 B.e极上在标准状况下生成0.224 L气体
C.b极上电极反应式4OH--4e- 2H2O+O2↑
2H2O+O2↑
D.乙烧杯中阳极生成O2消耗OH-,溶液酸性增强
10.今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、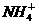 、Cl-、Mg2+、
、Cl-、Mg2+、
Ba2+、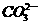 、
、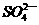 ,现取三份100 mL溶液进行如下实验:
,现取三份100 mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04 mol
(3)第三份加足量BaCl2溶液后 ,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。根据上述实验,以下推测正确的是
,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。根据上述实验,以下推测正确的是
A.K+一定存在
B.100 mL溶液中含0.0l mol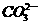
C.Cl-不可能存在 D.Ba2+一定不存在,Mg2+可能存在
9.用NA表示阿伏加德罗常数,下列说法正确的是
A.16 g O2和O3的混合气体中含O原子个数大于NA
B.1 mol Na2O2与足量CO2完全反应转移的电子总数为NA
C.1 L lmol·L-1 Na2CO3的溶液中含有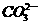 数为NA
数为NA
D.22.4 L任何气体的分子数均为NA
8.将液体Y滴加到盛有固体X的试管中,并在试管口对生成的气体进行检验。下表中固体X、液体Y及检验方法对应关系错误的是

7.下图所示:由短周期元素A、B形成的化合物甲在一定条件下发生如下反应,达到化学平衡状态,下列相关判断不正确的是
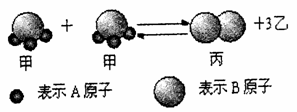
A.当消耗2 mol甲分子同时生成lmol丙分子,则说明反应达到化学平衡状态
B.丙分子的性质非常稳定
C.1个乙分子中含有2个A原子
D.该反应一定是氧化还原反应
20.从含银、铜、金和铂的金属废料中提取金、银、铂的一种工艺如下:
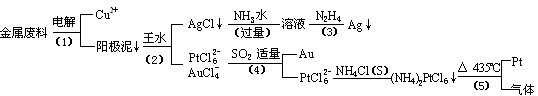
根据以上工艺回答下列问题:
(1) 电解时,以金属废料为阳极,纯铜为阴极,CuSO4溶液为电解液,
写出电解方程式:
阳极:
阴极: ;
(2)AgCl溶于氨水后所得的溶液含有的一种阳离子,在碱性条件下,也可用葡萄糖将其还原为银,写出该反应的离子方程式:
;
(3)写出步骤(4)的离子反应方程式:
;
(4)金和浓硝酸反应的化学方程式为:
Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O
但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,试简要解释之:
。
21
.⑴肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是 。
⑵肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液。肼-空气燃料电池放电时:正极的电极反应式是 。
负极的电极反应式是 。
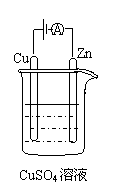 ⑶右图是一个电化学过程示意图。
⑶右图是一个电化学过程示意图。
① 锌片上发生的电极反应是
。
②假设使用肼-空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论上消耗标准状况下的空气
L(假设空气中氧气体积含量为20%)
⑷传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方程式
南昌市铁路一中2010-2011学年度高三12月月考 化学试卷
19.工业上电解饱和食盐水能制取多种化工原料,其中部分原料可用于制备多晶硅。
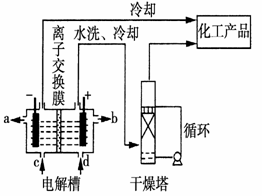
(1)如图是离子交换膜法电解饱和食盐水示意图,电解槽阳极产生的气体是________;NaOH溶液的出口为________(填字母);精制饱和食盐水的进口为________(填字母);干燥塔中应使用的液体是________。
(2)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用受到广泛关注。
①SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为__________________________________。
②SiCl4可转化为SiHCl3而循环使用。一定条件下,在20L恒容密闭容器中的反应:
3SiCl4(g)+2H2(g)+Si(g)
 4SiHCl3(g)
4SiHCl3(g)
达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为________kg。
(3)采用无膜电解槽电解饱和食盐水,可制取氯酸钠,同时生成氢气,现制得氯酸钠213.0kg,则生成氢气________m3(标准状况)。
18.X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。回答下列问题:
⑴ L的元素符号为________ ;M在元素周期表中的位置为________________;五种元素的原子半径从大到小的顺序是____________________(用元素符号表示)。
⑵ Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的电子式为___,B的结构式为____________。
⑶ 硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为_______,其最高价氧化物对应的水化物化学式为_______。该族2 ~ 5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是__________(填字母代号)。
a.+99.7 mol·L-1 b.+29.7 mol·L-1 c.-20.6 mol·L-1
d.-241.8 kJ·mol-1
⑷ 用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q 。写出阳极生成R的电极反应式:______________;由R生成Q的化学方程式:_______________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com