
题目列表(包括答案和解析)
4.下列对实验现象的预测不正确的是( )
A.向Na2SiO3溶液中通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失
B.向氢氧化铁胶体中滴加盐酸至过量,开始有沉淀出现,后来沉淀又溶解
C.向Ca(ClO)2溶液中通入CO2,溶液变浑浊,再加入品红溶液,红色褪去
D.向Ca(OH)2溶液中通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失,再加入过量NaOH溶液,溶液又变浑浊
3.“稀土”是我国宝贵的战略资源,国家即将控制其出口。  与
与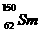 是稀土元素,下列有关说法不正确的是( )
是稀土元素,下列有关说法不正确的是( )
A.  与
与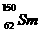 互为同位素 B. 我国有丰富的稀土资源
互为同位素 B. 我国有丰富的稀土资源
C.  与
与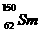 是不同的核素
是不同的核素
D. 据 与
与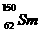 的质量数可以确定Sm元素的相对原子质量为147
的质量数可以确定Sm元素的相对原子质量为147
2.下列各组离子在指定溶液中能大量共存的是( )
①无色溶液中:K+、Na+、MnO、SO
②pH=11的溶液中:CO、Na+、AlO2-、NO
③加入Al能放出H2的溶液中:Cl-、HCO、SO、NH
④由水电离出的c(OH-)=1.0×10-13 mol·L-1的溶液中:Na+、Ba2+、Cl-、Br-
⑤有较多Fe3+的溶液中:Na+、NH、SCN-、HCO
A.①② B.③④ C.②④ D.③⑤
1.下列起固氮作用的化学反应是 ( )
A.N2与H2在一定条件下反应生成NH3 B.NO与O2反应生成NO2
C.由NH3制NH4HCO3和(NH4)2SO4 D.NH3经催化氧化生成NO
21.(8分)烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点。
(1)选择性催化还原法的脱硝原理为:
6NOx+4x NH3
 (3+2x)N2+6xH2O
(3+2x)N2+6xH2O
①上述反应中每转移3mol电子,生成标准状况下N2的体积为________L。
②已知:2H2(g)+O2(g) =2H2O (g) ΔH=-483.6 kJ·mol-1
N2(g)+3H2(g)=2NH3(g) ΔH=-92.4 kJ·mol-1
N2(g)+O2(g)=2NO(g) ΔH=-180.5kJ·mol-1
则反应6NO(g)+4NH3(g)=5N2(g)+6H2O(g)的ΔH=__________。
(2)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如下图1,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2所示。



图1 图2
①出该脱硝原理总反应的化学方程式:____________。
②为达到最佳脱硝效果,应采取的条件是____________。
20.(10分)氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制流程:


根据上述流程回答下列问题:
(1)混合①中发生反应的化学方程式为__________。
(2)混合①中使用冰水的目的是_______________。
(3)操作Ⅱ和操作Ⅲ的名称分别是_________、________。
操作Ⅲ一般适用于分离____________混合物。(选填编号)
a.固体和液体 b.固体和固体 c.互不相溶的液体 d.互溶的液体
(4)混合②中加入Na2SO3的目的是________________________________。
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)带有淡淡的黄色。于是甲乙两同学设计了简单实验加以探究:
甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为_____________,若假设成立可观察到的现象为__________________。
乙同学假设工业氢溴酸呈淡黄色是因为_______,其用于证明该假设所用的试剂为_____________。
19.(12分)某化学小组拟采用如下装置(夹持和加热仪器已略去)来电解饱和食盐水,并用电解产生的H2还原CuO粉末来测定Cu的相对原子质量,同时检验氯气的氧化性。

(1)为完成上述实验,正确的连接顺序为A连_______;B连_______(填写连接的字母)。
(2)对硬质玻璃管里的氧化铜粉末加热前,需要的操作为________________。
(3)若检验 氯气的氧化性,则乙装置的a瓶中溶液可以是_____________,对应的现象为___________________________________________________。
氯气的氧化性,则乙装置的a瓶中溶液可以是_____________,对应的现象为___________________________________________________。
(4)丙装置的c瓶中盛放的试剂为 _____________,作用是____________________。
(5)为测定Cu的相对原子质量,设计了如下甲、乙两个实验方案
精确测量硬质玻璃管的质量为a g,放入CuO后,精确测量硬质玻璃管和CuO的总质量为b g,实验完毕后
甲方案:通过精确测量硬质玻璃管和Cu粉的总质量为c g, 进而确定Cu的相对原子质量。
乙方案:通过精确测定生成水的质量d g,进而确定Cu的相对原子质量。
①请你分析并回答:________方案测得结果更准确。你认为不合理的方案的不足之处在________________________________。
②按测得结果更准确的方案进行计算,Cu的相对原子质量___________________。
18.(10分)下列转化关系图中,A、B、C、D、E常温下为气体,B、E、F、K为单质,其中F为黑色固体;C、D均能使澄清的石灰水变混浊,D、E均能使品红溶液褪色;I是一种红棕色固体氧化物。


请回答下列问题:
(1)C的电子式为_____________。
(2)检验溶液L中金属阳离子的方法是__________________。
(3)反应③的离子方程式为____________________________。
(4)F与G的浓溶液反应的化学方程式为__________________。
(5)气体A的密度为2.68g·L-1(标准状况),通过计算、推理,可确定A的分子式为________。
17.(12分)
(1)物质X、Y是中学化学中的常见物质,X既能与稀硫酸反应,又能与氢氧化钠溶液反应。
①若X为氧化物,X的化学式是____________。
②若X与稀硫酸反应生成无色无味的气体A,与浓氢氧化钠溶液加热反应生成气体B。等物质的量的A和B在水溶液中反应又生成X。
X与足量稀氢氧化钠溶液反应的离子方程式是___________________________。
③若X为金属单质,写出X与氢氧化钠溶液反应的化学方程式__________________;若Y为非金属单质,Y不能与浓、稀硫酸反应,却能与某种酸反应放出氢气,并与氢氧化钠溶液反应放出氢气。写出Y与氢氧化钠溶液反应的化学方程式并用单线桥法标明电子的转移_________________________。
(2)在宇航器中,可以不断的将座舱内的空气通过盛有金属过氧化物(以过氧化钠为例)的容器,以除去A。反应的化学方程式是_________________________________ 。
科学家设计出新的航天飞船内的空气更新系统。其中一步是A和氢气在200℃~250℃时,镍催化剂作用下,生成甲烷和另一种物质。该反应的化学方程式是______________。
16.将总物质的量为n mol的钠和铝(其中钠的物质的量分数为x),投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体V L。下列关系式中正确的是( )
A.x=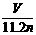 B.0 < x ≤ 0.5
B.0 < x ≤ 0.5
C.V=33.6n(1-x) D.11.2n < V ≤ 22.4n
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com