
题目列表(包括答案和解析)
14、对溶液中的离子进行鉴定,下列实验所得结论不合理的是( )
A.向溶液中加入稀硝酸后,再加入AgNO3溶液有白色沉淀生成,则溶液中可能含有Cl-
B. 向溶液中加入KSCN溶液,观察无明显现象,继续加入氯水,溶液变红色,说明溶液中一定含有Fe2+
C. 向溶液中加入NaOH溶液,加热后产生使湿润的红色石蕊试纸变蓝的气体,则可推测该溶液中含有NH4+
D. 向溶液中加入盐酸,产生使澄清石灰水变浑浊的无色无味气体,可推测溶液中含有CO32-。
13.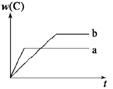 右图表示可逆反应A(s)+B(g)
右图表示可逆反应A(s)+B(g)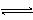 nC(g);ΔH=Q(n为正整数)在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线。下列有关叙述中一定正确的是( )
nC(g);ΔH=Q(n为正整数)在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线。下列有关叙述中一定正确的是( )
A. 其他条件相同,a表示使用了催化剂,b没有使用催化剂
B. 其他条件相同,若只改变温度,则a比b的温度高且ΔH>0
C. 其他条件相同,若只改变压强,则a比b的压强大且n≥2
D. 其他条件相同,若改变A的物质的量,则a比b消耗A的物质的量少
12. NA为阿伏加德罗常数,下列叙述中正确的是 ( )
A.0.1 mol PCl3中形成共价键的电子数是0.3NA
B.100 mL 1 mol/L NaHSO4 溶液中HSO4-数是0.1NA
C.标准状况下,11.2 L CO2和O3混合气体中含有的原子数是1.5 NA
D.17 g H2O2完全分解,转移电子数是1NA
11.下列化学反应的离子方程式正确的是( )
A.次氯酸钠漂液中加浓盐酸产生氯气:ClO- + Cl-+2H+=Cl2↑+H2O
B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3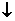 +2HClO
+2HClO
C.用稀HNO3溶解FeS固体:FeS+2H+=Fe2++H2S
D.氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO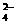 =CaSO4
=CaSO4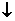 +H2O
+H2O
10.把0.6 mol X气体和0.4 mol Y气体混合于容积为2 L的容器中,使其发生反应
3X(g)+Y(g)===nZ(g)+2W(g).5 min末生成0.2 mol W,若测知以Z浓度变化表示的平均反应速率为0.01 mol/(L·min),则n的值为 ( )
A.1 B.2 C.3 D.4
9.下列变化规律错误的是( )
A.微粒半径:F – < Cl – < Br – < I – B.稳定性:HI< HBr <HCl< HF
C.沸点:HF< HCl < HBr< HI D.阴离子还原性:F – < Cl – < Br – < I –
8.下列叙述中正确的是(NA为阿伏加德罗常数)( )
A.通常状况下将0.5mol HI气体和0.5 mol Cl2混合后,气体的分子数小于NA
B.同温同压下,相同体积的物质,其物质的量必相等
C.5.3g Na2CO3固体含有的离子数为1.5NA
D.标准状况下,0.5 NA个Br2所占的体积约为11.2L
7. 如图所示是短周期的一部分,已知B原子与C 原子核外电子总数之和为A的4倍,则下列推断正确的是 ( )
如图所示是短周期的一部分,已知B原子与C 原子核外电子总数之和为A的4倍,则下列推断正确的是 ( )
A.A、B、C三者中,A为金属性元素,B、C为非金属性元素
B.A、B、C三者核电荷数之和为40
C.A与B、A与C均可形成离子化合物 D.B与C只能形成一种共价化合物
6.有a、b、c、d、e五种气体,进行下列实验:
|
(1)a和b混合 |
气体变红棕色 |
|
(2)c和d混合 |
产生白烟 |
|
(3)c和e分别通入少量溴水中 |
溴水都变成无色透明的液体 |
|
(4)b和e分别通入氢硫酸中 |
都产生淡黄色浑浊 |
a、b、c、d、e依次可能是( )
A.O2、NO、HCl、NH3、CO2 B.O2、NO、NH3、HCl、SO3
C.NO、O2、NH3、HCl、SO2 D.HCl、CO2、NH3、H2S、CH4
5、根据相关的化学原理,下列判断正确的是( )
A.由于水中存在氢键,所以稳定性:H2O>H2S
B.由于二氧化硅的相对分子质量比二氧化碳的大,所以沸点:SiO2>CO2
C.若A2 + 2D- == 2A- + D2,则氧化性D2>A2
D.若R2-和M+的电子层结构相同,则离子半径R2->M+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com