
题目列表(包括答案和解析)
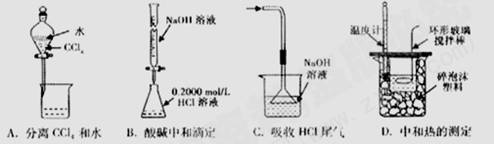
2.下列实验装置(固定装置略去)和操作正确的是
1.下列有关化学研究的正确说法是
A.同时改变两个变量来研究反应速率的变化,能更快得出有关规律
B.对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同
C.依据丁达尔现象可将分散系分为溶液、胶体与浊液
D.从H2S、HCl的酸性:H2S<HCl,可以推出非金属性:S<Cl
22.(12分)根据氨气还原氧化铜的反应,可设计测定铜元素相对原子质量么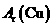 (近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量m(H20),由此计算
(近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量m(H20),由此计算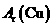 。为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的NH4C1与Ca(OH)2的量足以产生使CuO完全还原的氨气):
。为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的NH4C1与Ca(OH)2的量足以产生使CuO完全还原的氨气):
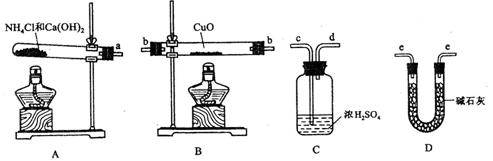
请回答下列问题:
(1)氨气还原炽热氧化铜的化学方程式为________________________________;
(2)从所提供的仪器及试剂中选择并组装本实验的一套合理、简单的装置,按气流方向的连接顺序为(用图中标注的导管口符号表示)a→______________________________;
(3)在本实验中,若测得m(CuO)= a g,m(H2O)= b g,则Ar(Cu)= _______________;
(4)在本实验中,使测定结果Ar(Cu)偏大的是_______________ (填序号);
① CuO未完全起反应 ② CuO不干燥
③ CuO中混有不反应的杂质 ④ 碱石灰不干燥
⑤ NH4C1与Ca(OH)2混合物不干燥
(5)在本实验中,还可通过测定_______________和_______________,或_______________和_______________达到实验目的。
21.(10分)A-F六种元素中,除A外均为短周期元素,它们的原子结构或性质如下表所示:
|
元素 |
结构或性质 |
|
A |
生活中常见的金属,它有两种氯化物,相对分子质量相差35.5 |
|
B |
二价阳离子与Ne原子具有相同的电子层结构 |
|
C |
形成化合物种类最多的元素之一,其单质为固体 |
|
D |
地壳中含量最多的元素 |
|
E |
与D同主族 |
|
F |
与E同周期,且最外层电子数等于电子层数 |
(1)A的某种氯化物的浓溶液可用于制作印刷电路铜板,反应的离子方程式为:
.
(2)CD2分子中化学键的类型是 ;
其与上述某元素形成的物质发生置换反应的化学方程式是 .
(3)F的最高价氧化物对应的水化物与E的最高价氧化物对应的水化物反应的离子方程式为 .
(4)由B、D两种元素形成的化合物的电子式为 .
20.(12分)一种白色晶体A极易溶于水,将A配成溶液进行如下框图所示的实验,实验现象及转化关系如下列框图所示。
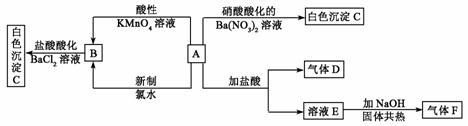
其中A为正盐,气体D能使品红溶液褪色,气体F能使湿润的红色石蕊试纸变蓝。试回答下列问题:
(1)写出下列物质化学式:A:_________________;C:_________________;
(2)写出E的电子式_____________;F的结构式__________________
(3)写出下列反应的离子方程式:
①由B生成C:________________________________________________________
②A和新制氯水反应:___________________________________________________。
19.(8分)在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g) 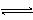 2NO2(g)(正反应为放热反应)体系中,n(NO)随时间的变化如下表:
2NO2(g)(正反应为放热反应)体系中,n(NO)随时间的变化如下表:
|
时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)如图中表示NO2变化曲线的是 .用O2表示从0 s-2
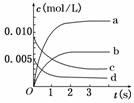 内该反应的平均速率v= . mol/(L·s)
内该反应的平均速率v= . mol/(L·s)
(2)能说明该反应已达到平衡状态的是 .
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v(NO)逆=2v(O2)正 d.容器内密度保持不变
(3)能使该反应的反应速率增大,且平衡向正反应方向移动的是 .
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
18.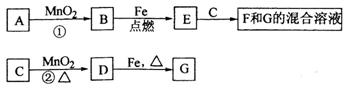 (10分)A-G各物质间的关系如下图,其中B、D为气态单质。
(10分)A-G各物质间的关系如下图,其中B、D为气态单质。
请回答下列问题:
(1)物质C和E的名称分别为________________、__________________;
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式为_____________;
若只能在加热情况下进行,则反应物A应为_____________;
(3)反应②的化学方程式为_______________________________________;
(4)新配制的F溶液应加入_____________以防止其转化为G。检验G溶液中阳离子的常用试剂是_____________,实验现象为____________________________________________。
17. (8分)某化学反应的反应物和产物如下:Al+NaNO3+H2O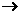 Al(OH)3+N2+NaAlO2
Al(OH)3+N2+NaAlO2
(1)该反应的氧化剂是_____________。(2)该反应的氧化产物是______________。
(3)反应过程中转移5 mol e-,生成标准状况下N2的体积__________ L。
(4)配平该反应的化学方程式:
___Al+____NaNO3+___H2O ===______Al(OH)3+____N2+___NaAlO2。
16、将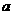 mol钠和
mol钠和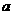 mol铝一同投入
mol铝一同投入 g足量水中,所得溶液密度为
g足量水中,所得溶液密度为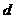 g·mL-1,该溶液中溶质质量分数为 ( )
g·mL-1,该溶液中溶质质量分数为 ( )
A.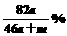 B.
B. % C.
% C.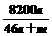 % D.
% D.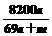 %
%
第Ⅱ卷 非选择题(共60分)
15、某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化的图象如下所示,下列说法正确的是
A.原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+[
B.原溶液中一定含有SO42-和Na+
C.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
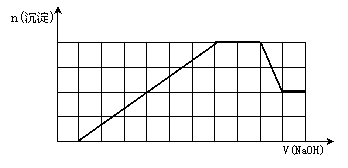 D.反应最后形成的溶液中含有的溶质为Na2SO4
D.反应最后形成的溶液中含有的溶质为Na2SO4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com