
题目列表(包括答案和解析)
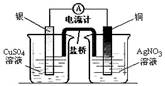
14.已知A、B、C、D、E是短周期元素中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法正确的是 ( )
A.元素B位于元素周期表中第二周期第VIA族
B.一定条件下,元素C、D的最高价氧化物对应的水化物之间不能发生反应
C.工业上常用电解法制备元素C、D、E的单质
D.化合物AE与CE具有相同类型的化学键
13.下列装置能达到实验目的的是( )

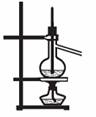

① ② ③ ④
A.实验室用装置①制取氨气 B.装置②将化学能转化为电能
C.装置③可用于分离沸点相差较大的互溶液体混合物
D.装置④中X若为四氯化碳,可用于吸收氨气,并防止倒吸
12.下列叙述正确的是( )
A.在原电池的负极和电解池的阴极上都发生失电子的氧化反应
B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1∶2
C.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 mol NaOH
D.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
11、根据下列实验现象,所得结论正确的是( )
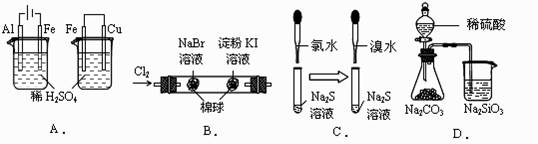
|
实验 |
实验现象 |
结论 |
|
A. |
左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 |
活动性:Al>Fe>Cu |
|
B. |
左边棉花变为橙色,右边棉花变为蓝色 |
氧化性:Cl2>Br2>Ⅰ2 |
|
C. |
左边溶液产生黄色沉淀,右边溶液产生黄色沉淀 |
氧化性:Cl2>Br2>S |
|
D. |
锥形瓶中有气体产生,烧杯中液体变浑浊 |
非金属性:S>C>Si |
10、下列离子方程式错误的是( )
A、向偏铝酸钠溶液中滴加少量盐酸:AlO2-+ H+ + H2O = A1(OH)3↓
B、碳酸氢钠溶液与过量的石灰水:Ca2+ + HCO3-+ OH- = CaCO3↓+ H2O
C、向三氯化铁溶液中加入过量铜屑:2Fe3+ + Cu = 2Fe2+ + Cu2+
D、用NaOH溶液吸收少量H2S 气体:OH一+ H2S = HS一+ H2O
9.亚氨基羟锂(Li2NH)是一种储氢容量器,安全性好的固体储氢材料,其储氢原理可表示为Li2NH+H2=LiNH2+LiH。下列有关说法正确的是 ( )
A. Li2NH中N的化合价是-1 B.该反应中H2既是氧化剂又是还原剂
C.Li+和H-的离子半径相等 D.此法储氢和钢瓶储氢的原理相同
8.下列各组溶液中,可能大量共存的离子有 ( )
A.含有大量 Ba2+的溶液中: HCO3-、 Ag+、 Fe3+、 Cl-
B.滴加甲基橙试液后呈红色的溶液中: Na+、 CO32-、 K+、 AlO2-
C.由水电离的c (OH- ) = 10-14mol·L-1的溶液中:CH3COO-、C6H5O-、Na+、K+
D.加入铝粉后产生氢气的溶液中: NH4 +、 Na+、 NO3- 、Cl-
7.某合作学习小组讨论辨析:①漂白粉和酸雨都是混合物 ②煤和石油都是可再生能源 ③不锈钢和目前流通的硬币都是合金 ④硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 ⑤蛋白质溶液、淀粉溶液和雾都是胶体。上述说法正确的是( )
A.①③⑤ B.①②④ C.②③④ D.③④⑤
6.用NA表示阿伏加德罗常数的值。下列叙述正确的是 ( )
A.1.2g NaHSO4晶体中阳离子和阴离子的总数为0.03 NA
B.100 mL 18.4 mol·L-1硫酸与足量铜反应,生成SO2的分子数为0.92 NA
C.1 L 1 mol/L的K2CO3溶液中离子总数小于3NA
D.室温下,42.0g乙烯和丙烯的混合气体中含有的碳原子数为3NA
5.下列有关反应热的叙述正确的是( )
A.已知2H2(g)+O2(g)===2H2O(g);ΔH=-483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol
B.C(石墨,s)===C(金刚石,s);ΔH>0,所以金刚石比石墨稳定
C.已知碳的燃烧热为ykJ/mol,当7.2g的碳在12.8g的氧气中燃烧,至反应物耗尽并放出xkJ的热量,则可求出1mol碳与氧气反应生成一氧化碳时ΔH=(0.5y-2.5x)kJ/mol
D.己知2C(s)+2O2(g)===2CO2(g);ΔH1 2C(s)+O2(g)===2CO(g);ΔH2,则ΔH1>ΔH2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com