
题目列表(包括答案和解析)
5.下列各组比较中,前者比后者大的是
A.25℃时,pH均为2的H2SO4溶液和盐酸中氢离子的物质的量浓度
B.25℃时,pH均为2的盐酸和CH3COOH溶液中溶质的物质的量浓度
C.同温度、同浓度的NaCl溶液和氨水的导电能力
D.25℃时,pH均为3的盐酸和FeCl3溶液中水的电离程度
6
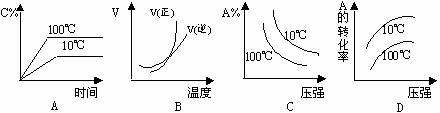 .下列图象能正确地表达可逆反应3A(g)+B(g)
.下列图象能正确地表达可逆反应3A(g)+B(g)  2C(g)(ΔH<0)的是
2C(g)(ΔH<0)的是
4.下列各组离子中,在给定条件下能大量共存的是
A.在pH=1的溶液中:NH4+、K+、ClO-、Cl-
B.有SO42-存在的溶液中:Na+ 、Mg2+、Ca2+、I-
C.有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+ 、Br-
D.在c(H+)=1.0×10-13mol·L-1的溶液中:Na+、S2-、[Al(OH)4 ]-、SO32-
3.下列反应中,既属于氧化还原反应,又是吸热反应的是
A.铝片与稀盐酸反应 B.灼热的碳与CO2反应
C.Ba(OH)2·8H2O与NH4Cl反应 D.甲烷在氧气中的燃烧反应
2. 某反应2AB(g) C(g)+3D(g)在高温时能自发进行,其逆反应在低温下能自发进行,则该反应的ΔH、ΔS应为
某反应2AB(g) C(g)+3D(g)在高温时能自发进行,其逆反应在低温下能自发进行,则该反应的ΔH、ΔS应为
A.ΔH <0,ΔS>0 B.ΔH <0,ΔS<0
C.ΔH >0,ΔS>0 D.ΔH >0,ΔS<0
1.下面四个选项是四位同学在学习过化学反应速率和化学平衡理论以后,联系化工生产实际所发表的看法,其中,你认为不正确的是
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.化学平衡理论可指导怎样使用有限原料多出产品
C.化学反应速率理论可指导怎样提高原料的转化率
D.正确利用化学反应速率和化学平衡理论都可提高化工生产的综合经济效益
23.(14分)原子序数由小到大排列的四种短期周元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)X、Y、Z、W四种元素形成的简单离子,按离子半径由大到小的排列顺序是
(用离子符号表示)
(2)由X、Y、Z、W四种元素的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为 。
(3)由X、Y、Z、W四种元素组成的一种离子化合物A
①已知1molA能与足量NaOH浓溶液反应生成标准状况下44.8L气体。写出加热条件下A与NaOH溶液反应的离子方程式 。
②又知A既能与盐酸反应,又能与氧水反应,写出A与足量盐酸反应的离子方程式:
。
③写出检验A溶液中主要阳离子的方法 。
(4)由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1molB中含有6mol结晶水。对化合物B进行如下实验:
a.取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色;
b.另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解
①B的化学式为 。
②已知1mol·L-1100mLB的溶液能与1mol·L-120mL KMnO4溶液(硫酸酸化)恰好反应。写出反应的离子方程式 。

22.(11分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g) Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
(1)该反应的氧化剂是 ,其还原产物是 ;
(2)该反应的平衡常数表达式为K= ;
(3)若知上述反应为吸热反应,则其反应热△H 0(填“>”、“<”或“=”)
升高温度,其平衡常数值 (填“增大”“减小”或“不变”);若已知CO生成速率为v(CO)=18mol·L-1·min-1,则N2消耗速率为v(N2)= 。

(4)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率v与时间t关系如上图所示。图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中CO的含量最高的一段时间是 。
(5)若某温度下1L密闭容器中,足量的SiO2和C与2mol N2充分反应,达平衡后N2的转化率为50%,求该温度下的平衡常数。
21.(8分)下图所示的框图中,单质A是使用最广泛的金属,单质E要作半导体材料;氧化物乙在通常状况下为液体,氧化物丙易与人体血液中的血红蛋白结合而使人中毒。
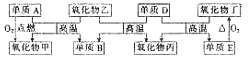
请回答下列问题:
(1)写出单质A、B的化学式为 、 。
(2)写出反应D+丁 E+丙的化学方程式:
。
E+丙的化学方程式:
。
(3)将36g气态氧化物乙与足量固态单质D充分反应,生成33.6g氧化物丙和一定量单质B,同时吸收157.2kJ热量,写出该反应的热化学方程式: 。
(4)将23.2g氧化物甲加入150mL 8.0mol·L-1盐酸中充分溶解,然后加入150mL 8.5mol·L-1NaOH溶液,充分振荡、静置后过滤,所得沉淀经洗涤后充分灼烧,最终得到固体的质量为 g。
20.(7分)现有含NaCl、Na2SO4、NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO2-4、NO-3的相互分离。相应的实验过程可用下面的流程图表示。
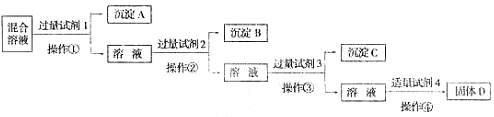
(1)写出上述实验过程中所用试剂的名称:
试剂1 ;试剂2 ;试剂4
(2)加入过量试剂3的目的是 。
(3)在加入试剂4后,获得固体D的实验操作④是 (填操作名称)
19.I.(2分)
化学是一门以实验为基础的学科,化学实验是化学学习的重要内容。根据你掌握的知识判断,下列实验操作的描述中,正确的是 。(填写下列各项序号)
A.从试剂瓶中取出的任何药品,若有剩余不能再放回原试剂瓶
B.用稀盐酸洗涤盛放过石灰水的试剂瓶
C.配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸
D.各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘纸上称量
E.Na2CO3溶液不能保存在带有玻璃塞的试剂瓶中
F.将用水润湿的pH试纸,浸入稀盐酸溶液,测定溶液的pH
II.(12分)
|
(1)该化学业小组所制得的气体中混有的主要杂质气体可能是 (填分子式)。产生这种结果的主要原因是 (用化学方程式和必要的文字加以说明)
(2)为证实相关分析,化学小组的同学设计了实验,组装了如下装置,对所制取的气体进行探究。

①装置B中加入的试剂 ,作用是 。
②装置D中加入的试剂 ,装置F中加入的试剂 。
③可证实一定量的锌粒和一定量的浓硫酸反应后生成的气体中混有某杂质气体的实验现象是 。
④U型管G的作用为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com