
题目列表(包括答案和解析)
3.下列各组离子在溶液中能大量共存的是 ( )
A.Ca2+、 Na+ NO3- SO32- B.H+ Na+ CH4COO- I-
C.Ba2+ OH- Na+ Br- D.C1O- Na+ S2- OH-
2.水热反应是指在高温高压的永环境条件下,将二氧化碳转化为有机物的技术。水热反应不仅能实现二氧化碳到有机物的转化,还可以将有机质转化成矿物能源,也可将废水中的有机物转化成煤炭等资源。下列说法不正确的是 ( )
A.水热反应一定包含化学变化 B.水热反应可以降低自然界中碳的含量
C.水热反应可以改善温室效应 D.水热反应可重建地球上碳资源的和谐循环
1.2010年4月7日,俄罗斯科学家宣布在实验中获得了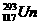 和
和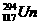 两种新原子。下列有关这两种原子的说法错误的是 ( )
两种新原子。下列有关这两种原子的说法错误的是 ( )
A.质量数均超过质子数的两倍 B.互称为同位素
C.中子数分别为176、177 D.是同一种核素
23.(10分)复分解反应是中学化学中常见的一种反应类型。 (1)已知在常温下测得浓度均为0.1 mol·L-1的下列6种溶液的pH值:
|
溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
C6H5ONa |
|
pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
11.3 |
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3 = 2CH3COONa+CO2↑+H2O 若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是___________(填编号)。
A.CO2+H2O
+2NaClO = Na2CO3+2HClO
B.CO2+H2O
+NaClO = NaHCO3+HClO
C.CO2
+H2O +C6H5ONa NaHCO3+C6H5OH
D.CO2
+H2O +2C6H5ONa
NaHCO3+C6H5OH
D.CO2
+H2O +2C6H5ONa Na2CO3+2C6H5OH
E.Na2CO3+C6H5OH
Na2CO3+2C6H5OH
E.Na2CO3+C6H5OH NaHCO3+C6H5ONa
F.CH3COOH+NaCN
= CH3COONa+HCN
(2)根据前述信息判断,常温下,浓度均为0.05 mol·L-1的下列5种物质的溶液中,pH最小的是
(填编号),其pH值为_______(填数值);pH最大的是 (填编号)。
①HCN ②CH3COOH ③HClO4 ④HClO ⑤H2SO4
(3)一些复分解反应的发生还遵循其它的规律。下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液
②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体
NaHCO3+C6H5ONa
F.CH3COOH+NaCN
= CH3COONa+HCN
(2)根据前述信息判断,常温下,浓度均为0.05 mol·L-1的下列5种物质的溶液中,pH最小的是
(填编号),其pH值为_______(填数值);pH最大的是 (填编号)。
①HCN ②CH3COOH ③HClO4 ④HClO ⑤H2SO4
(3)一些复分解反应的发生还遵循其它的规律。下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液
②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体
请根据上述反应,总结出复分解反应发生的另一规律:
。
(4)根据(3)中结论,现将KI溶液和AgCl固体混合搅拌,则可能会观察到的现象是 ,反应的离子方程式为 。
22.(8分)高炉炼铁过程中发生的主要反应为
1/3Fe2O3(s)
+ CO(g) 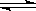 2/3Fe(s)
+ CO2(g)
2/3Fe(s)
+ CO2(g)

已知该反应在不同温度下的平衡常数如上表:
请回答下列问题:
(1)该反应的平衡常数表达式K=_____________,△H________0(填“>”、“<”或“=”)。
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过l0 min后达到平衡。求该时间范围内反应的平均反应速率υ(CO2)= ,CO的平衡转化率为________。
(3)欲提高(2)中CO的平衡转化率,可采取的措施是_____________。
A.减少Fe的量 B.增加Fe2O3的量 C.移出部分CO2
D.提高反应温度 E.减小容器的容积 F.加入合适的催化剂
21.(10分)(1)在温度t℃时,某溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12,则t______25(填“大于”、“小于”或“等于”)。
(2)常温下,向某Ba(OH)2溶液中逐滴加入pH=x的盐酸,测得混合溶液的部分pH如下表所示:
|
序号 |
氢氧化钡的体积/mL |
盐酸的体积/mL |
溶液的pH |
|
① |
22.00 |
0.00 |
12 |
|
② |
22.00 |
18.00 |
11 |
|
③ |
22.00 |
22.00 |
7 |
x = _____。Ba(OH)2溶液的物质的量浓度为 。
⑶常温下,向100mLpH=2的硫酸与硫酸钠的混合溶液中,加入300mL上述Ba(OH)2溶液,沉淀正好达最大
量,此时溶液的pH 7(填“大于”、“小于”或“等于”);原混合溶液中硫酸钠的物质的量浓度
为 。
20.(8分)如下图所示,若电解5min时铜电极质量增加2.16g,试回答:
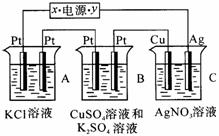
(1)电源电极x名称为 。
(2)pH变化:B ,C 。(填“增大”“减小”或“不变”)
(3)通电5min时,B中共收集到224mL气体(标况),溶液体积为200mL,则通电前CuSO4溶液的物质的量浓度为 (设电解前后溶液体积无变化)。
(4)若A中KCl溶液的体积也是200mL,电解后,溶液的pH是________(设电解前后溶液体积无变化)。
19.(6分)熔融盐燃料电池具有高的发电效率,因而受到重视。某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池负极电极反应式为:2C4H10+26CO32--52e- → 34CO2+10H2O。试回答下列问题:
(1)该燃料电池的化学反应方程式为 ;
(2)正极电极反应式为 。
(3)为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此,必须在通入的空气中加入一种物质,加入的物质是 ,它来自 。
18.(7分)(1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水,当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态双氧水反应,生成氮气和水蒸气,放出256kJ的热量。
①写出该反应的热化学方程式 。
②又已知H2O(l) = H2O(g),△H = 44 kJ•mol-1,则16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ 。
(2)实验室用足量的金属锌与体积、浓度一定的稀硫酸反应制取氢气时(不考虑温度变化),要想使反应速率减慢,又不影响产生氢气的总量,下列措施中能达到目的的是 。
①加入少量固体碳酸钠; ②加入少量固体醋酸钠;
③加入适量的硫酸钠溶液; ④加入适量的硝酸钠溶液;
⑤滴加少量CuSO4溶液; ⑥加热
17.常温下,下列有关离子浓度及pH大小的比较,正确的是
A. NH4+ 浓度相同的下列溶液: ①(NH4) 2 Fe(SO4)2 ②(NH4) 2 CO3 ③(NH4) 2SO4 ,
溶液浓度由大到小的顺序是:③>②>①
B. 由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,其离子浓度不可能是:
c(CH3COO-)>c(Na+)> c(H+) > c(OH-)
C. pH=13的Ba(OH)2溶液与pH=1的HCl溶液等体积混合后,混合溶液的pH>7
D. pH=12的Ba(OH)2溶液与pH=14的NaOH溶液等体积混合,混合溶液的pH范围是13<pH<14
高三教学质量调研
化学试题(A)
第Ⅱ卷(非选择题 共49分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com