
题目列表(包括答案和解析)
1.将CO2转化成有机物,可有效实现碳循环。CO2转化成有机物的例子很多,以下反应中,最节能的是
A.6CO2 + 6H2O C6H12O6 B.CO2 + 3H2
C6H12O6 B.CO2 + 3H2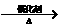 CH3OH
+H2O
CH3OH
+H2O
C.CO2 + CH4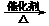 CH3COOH
D.2CO2
+ 6H2
CH3COOH
D.2CO2
+ 6H2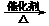 CH2=CH2 + 4H2O
CH2=CH2 + 4H2O
22.(10分)铬是水体的主要污染物之一,可以导致水生生物死亡。化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该有害物质。例如处理铬的实验循环示意图如下:
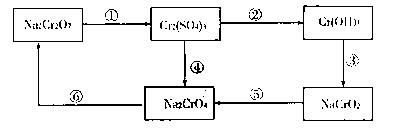
(1)在上圉所示的编号步骤中,其中反应①所用的试剂是硫酸酸化的H2O,请写出该反应的离子方程式方程式可以不配平
(2)现有含Cr3+和Fe3+的溶液,使用NaOH溶液和盐酸溶液,可将这两种离子相互分离,根据上图信息分析,在涉及的过滤操作中,上述两种离子的存在形态分别是 、 (写化学式
(3)铬的化台价除了示意图中涉及的+3和+6价外,还有0,十2,+4和+5价等。现有24mL浓度为0.05 mol·L-1的Na2SO3溶液恰好与20mL浓度为0.02 mol·L-1的Na2Cr2O7溶液完全反应。已知Na2SO4被Na2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为____;
(4)已知298K时, Cr(OH)3的溶度积常数KSP=6.3×10-31(mol·L-1)4,取少量Cr2(SO4)3溶液,加入一定量的氨水达到沉淀溶解平衡,测得pH=11,则此温度下残留在溶液中Cr3+的浓度为 mol·L-1。
21.(10分)由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各界的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),该反应的能量变化如右图所示:
CH3OH(g)+H2O(g),该反应的能量变化如右图所示:
 (1)上述反应平衡常数K的表达式为
,
(1)上述反应平衡常数K的表达式为
,
温度降低,平衡常数K____(填“增大…不变”
或“减小”)。
(2)在体积为2L的密闭容器中,充入1molCO2和
3molH,,测得 CO2的物质的量随时间变化如下
表所示。从反应开始到5min末,用氢气浓度变
化表示的平均反应速率v(H2)= 。
|
t/min |
0 |
2 |
5 |
10 |
15 |
|
N(CO2)/mol |
1 |
0.75 |
0.5 |
0.25 |
0.25 |
(3)在相同温度容积不变的条件下,能说明该反应已达平衡状态的是____ (填写序号字母);
a.n(CO2):n(H2):n(CH3OH):n(H2O)=1:3:1:1
b.容器内压强保持不变
c.H,的消耗速率与CH3OH的消耗速率之比为3:1
d.容器内的密度保持不变
(4)下列条件能使上述反应的反应速率增大,且平衡向正反应方向移动的是____(填写序号字母)。
a.及时分离出CH3OH气体
b.适当升高温度
c.保持容器的容积不变,再充入1molCO2和3molH2
d.选择高效的催化剂
20.(10分)2010年亚运会在我国广州成功举办,整个亚运会体现了环保理念。
(1)广州亚运会火炬“潮流”采用了丙烷(C3H8)作为燃料,燃烧后的产物为水和二氧化碳。在298K时,1mol丙烷完全燃烧生成CO2和液态水放出2221.5kJ的热量,则该反应的热化学方程式为 。
又知:在298K时C3H8(g)=C3H6(g)+H2(g) △H=124.2 kJ·mol-1,
H2(g)+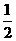 O2(g)=H2O(I) △H= -285.8kJ·mol-1,
O2(g)=H2O(I) △H= -285.8kJ·mol-1,
则l mo1C3H6完全燃烧生成CO2和液态水时放出的热量是____kJ。
(2)广州是一座美丽的海滨城市,海水资源非常丰富。
①海洋电池是以铝为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流,电池总反应为:4Al+3O2+6H2O=4A1(OH)3,下列说法正确的是____(填写序号字母);
a.电池工作时,电流由铝电极沿导线流向铂电极
b.铂电极采用网状比块状更利于O2放电
c.海水中的OH向铝电极方向移动
②用惰性电极电解200mLl.5mol.L食盐水;电解2min时,两极共收集到448mL
气体(标准状况下).写出该电解反应的离子方程式 。
假设电解前后溶液的体积不变,则电解后该溶液的pH为____。
19.(10分)X、Y、Z三种短周期元素,它们的原子序数之和等于16,X2、Y2、Z2在常温下都是无色气体,它们均为工业合成某化工厂的重要原料,其流程如下:
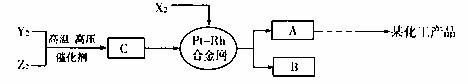
已知:①一定条件下,X2与Y2能反应生成A,X2与Z2能反应生成B;
②B和C分子均为常见的10电子微粒。
请回答下列问题:
(1)X元素在周期表中的位置是____ ;
(2)X2与Z2可制成新型化学电源(KOH溶液作电解质溶液).两个电极均由多孔石墨制成,通入的气体在电极表面放电,负极电极反应式为 ;
(3)化合物B吸收 C后形成的溶液pH 7(填“大于”“小于”或“等于”),其原因是(用化学用语表示) 。
(4)写出由C生成A和B的化学方程式 ;
18.(8分)A、B、C、 D均为中学常见物质,其中A为单质B、C、D为化台物,并且存在如下转化关系:
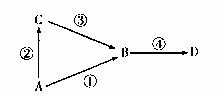
试回答下列问题:
(1)B与C为氧化物,D是一种盐,俗名纯碱
①若A为金属单质,写出反应④的化学方程式为 ;
②若A为非金属单质,则符合转化④的一个反应的离子方程式为
;
(2)若A为淡黄色非金属单质,B为气态氧化物,是空气的重要污染物之一,C为气态氢化物。试写出B与C反应的化学方程式____ ;
(3)若A为金属单质-常用于制作燃烧弹、信号弹。C为氧化物,且反应①③均需加入强碱溶液才能发生,则反应①的离子方程式为_________________。
17.(12分)高纯氧化铁( Fe2O3)是现代电子工业的重要材料。实验室用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高纯氧化铁的步骤如下:
Fe2O3)是现代电子工业的重要材料。实验室用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高纯氧化铁的步骤如下:
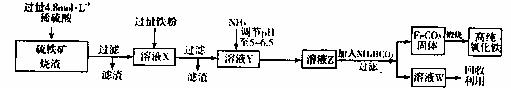
试回答下列问题:
(1)实验室用18.4 mol·L-1的浓硫酸配制150 mL4.8mol·L的硫酸溶液,所用的玻璃仪器除胶头滴管、量筒、烧杯、玻璃棒和酸式滴定管外,还需 (填写仪器名称);
(2)溶液X中加入铁粉后可能发生反应的离子方程式为 ;
(3)某同学选用下列装置来制备纯净干燥的氨气,请完成下列有关问题
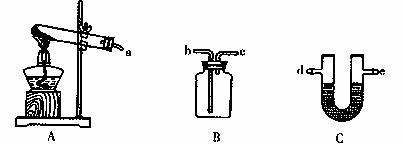
①装置A中可以选用下列试剂中的____(填写序号字母);
a.(NH4)2SO4和生石灰 b .NH4C1和Ca(OH)2固体
c.NH4HCO3固体 d .NH4C1固体
②装置c中试剂最好是____(填写试剂名称);
③收集NH2时,气体应由____(填写导管口代号)通入。
(4)写出氨水与NH4HCO3溶液反应的离子方程式 。
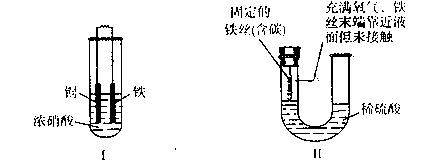
16.下列与反应原理相关的叙述不正确的是 ( )
A..装置I中不可能发生如下反应:Fe +2Fe3+=3Fe2+
B..装置Ⅱ在反应结束时溶液中存在Fe2+
C.装置I的溶液若换为稀硝酸,则腐蚀过程与原装置不同
D.装置Ⅱ中的铁丝能发生电化学腐蚀
第Ⅱ卷(非选择题,共60分)
15.下列叙述正确的是 ( )
A.装置I在反应过程中自始至终只生成红棕色气体
B.装置Ⅱ开始阶段铁丝只发生析氢腐蚀
C.装置Ⅱ在反应过程中能产生氢气
D.装置I在反应结束时溶液中的金属阳离子只有Cu2+
14.cu2O也是一种半导体材料,用作制造整流器的材料,
还可以用于制船底防污漆(杀死低级海生动物)、
农作物的杀菌剂。在实验室里可模拟工业过程制
通电
取Cu2O,总反应式是2Cu+H2O CuO2+H2↑,
其装如右图,下列有关说法不正确的是( )
A.该实验符合绿色化学的设计理念
B.图中的虚线框内需连接直流电源,且正极与石墨相连
C.CuO高温加热分解也可以得到Cu2O
D.上述装置中,阳极的电极反应式是2Cu +2OH-→Cu2O +H2O +2e-
下面两套实验装置,都涉及到金属的腐蚀反应,假设其中的金属块和金属丝都是足量的。请同学们仔细观察,完成15-16题
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com