
题目列表(包括答案和解析)
20.(10分)用广谱高效的二氧化氯(ClO2)替代液氯进行消毒,可避免产生对人体健康有害的有机氯代物。
(1)工业上,ClO2常用NaClO3和Na2SO3溶液混合并加硫酸酸化后反应制得,在该反应中NaClO3和Na2SO3的物质的量之比为 ▲ 。
(2)有效氯含量是含氯消毒剂的一个重要指标,有效氯含量的定义为:从HI中氧化出相同量的I2所需Cl2的质量与指定含氯消毒剂的质量之比,常用百分数表示。则ClO2的有效氯含量是 ▲ 。
(3)化学小组的同学欲对用ClO2消毒过的自来水进行氯元素含量的测定(假定ClO2全部转化为Cl-),他们进行了如下实验:向30.00 mL水样中加几滴K2CrO4溶液作指示剂,用0.001000 mol·L-1 AgNO3溶液滴定,当有砖红色Ag2CrO4沉淀出现时,达滴定终点,此时用去AgNO3溶液12.12 mL。
①水样中Cl-的物质的量浓度是 ▲ 。
②已知Ksp(AgCl) = 1.78×10-10,Ksp(Ag2CrO4) = 2.00×10-12。如在滴定终点时,测得溶液中CrO42-的浓度是5.000×10-3 mol·L-1。试计算此时溶液中Cl-的浓度是多少。
19.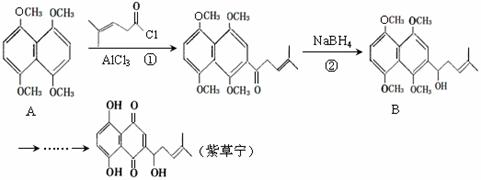 (14分)紫草宁具有多种生物活性,能抗菌、消炎、抗肿瘤等。合成紫草宁的部分工艺流程如下:
(14分)紫草宁具有多种生物活性,能抗菌、消炎、抗肿瘤等。合成紫草宁的部分工艺流程如下:
(1)紫草宁中的含氧官能团的名称是 ▲ ,它含有 ▲ 个手性碳原子。
(2)反应①、②的反应类型分别是 ▲ 、 ▲ 。
(3)A中含有萘环结构,M与A互为同分异构体,且符合下列条件:(a)M也含有萘环结构,且环上的一氯取代物只有一种;(b)1 mol M能与足量的金属钠反应生成2 mol H2;(c)M不能与Na2CO3溶液反应。
则M可能的结构简式为 ▲ (任写一种)。
(4)B能发生消去反应,该反应的化学方程式为 ▲ 。
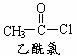 (5)结合题给信息,写出由苯、乙酰氯(结构简式如右图)制备
(5)结合题给信息,写出由苯、乙酰氯(结构简式如右图)制备
聚苯乙烯的合成路线流程图(无机试剂任选)。
合成路线流程图示例如下:
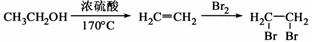
18.(12分)从废钯催化剂(该催化剂的载体为活性炭,杂质元素有铁、镁、铝、硅、铜等)中提取海棉钯(含Pd>99.9%)的部分工艺流程如下:
将最后所得到的滤液,经过一定的操作后可得到海棉钯。
(1)废钯催化剂经烘干后,再在800℃的高温下焙烧,焙烧过程中需通入足量空气的原因是 ▲ ;焙烧时钯转化为氧化钯(PdO),则甲酸还原氧化钯的化学方程式为 ▲ 。
(2)钯精渣中钯的回收率高低主要取决于王水溶解的操作条件,已知反应温度、反应时间和王水用量对钯回收率的影响如图1-图3所示,则王水溶解钯精渣的适宜条件为 ▲ 、 ▲ 、 ▲ 。
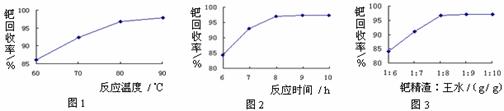
(3)王水是浓硝酸与浓盐酸按体积比1∶3混合而成的,王水溶解钯精渣的过程中有化合物A和一种无色、有毒气体B生成,并得到滤渣。
①气体B的分子式: ▲ ;滤渣的主要成分是 ▲ 。
②经测定,化合物A由3种元素组成,有关元素的质量分数为Pd:42.4%,H:0.8%,则A的化学式为 ▲ 。
17.(8分)燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等。
(1)对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物,如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H =-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H =-1160 kJ·mol-1
则CH4(g)将NO2(g)还原为N2(g)等的热化学方程式为 ▲ 。
(2)将燃煤废气中的CO2转化为甲醚的反应原理为:
 2CO2(g)
+ 6H2(g)
CH3OCH3(g) + 3H2O(g)
2CO2(g)
+ 6H2(g)
CH3OCH3(g) + 3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
|
投料比[n(H2) / n(CO2)] |
500 K |
600 K |
700 K |
800 K |
|
1.5 |
45% |
33% |
20% |
12% |
|
2.0 |
60% |
43% |
28% |
15% |
|
3.0 |
83% |
62% |
37% |
22% |
①若温度升高,则反应的平衡常数K将 ▲ (填“增大”、“减小”或“不变”。下同);若温度不变,提高投料比[n(H2) / n(CO2)],则K将 ▲ 。
②若用甲醚作为燃料电池的原料,请写出在碱性介质中电池负极的电极反应式
▲ 。
③在②所确定的电池中,若通入甲醚(沸点为-24.9 ℃)的速率为1.12 L·min-1(标准状况),并以该电池作为电源电解2 mol·L-1 CuSO4溶液500 mL,则通电30 s后理论上在阴极可析出金属铜 ▲ g。
16.(10分)稀土元素是周期表中IIIB族钪、钇和镧系元素的总称,它们都是很活泼的金属,性质极为相似,常见化合价为+3。其中钇(Y)元素是激光和超导的重要材料。我国蕴藏着丰富的钇矿石(Y2FeBe2Si2O10),以此矿石为原料生产氧化钇(Y2O3)的主要流程如下:
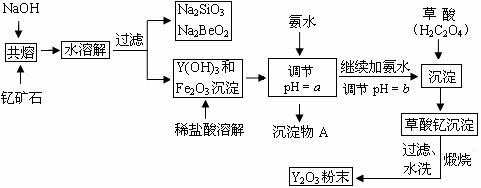
已知:①有关金属离子形成氢氧化物沉淀时的pH如下表:
|
|
开始沉淀时的pH |
完全沉淀时的pH |
|
Fe3+ |
2.7 |
3.7 |
|
Y3+ |
6.0 |
8.2 |
②在周期表中,铍、铝元素处于第二周期和第三周期的对角线位置,化学性质相似。
(1)钇矿石(Y2FeBe2Si2O10)的组成用氧化物的形式可表示为 ▲ 。
(2)欲从Na2SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀。则
①最好选用盐酸、 ▲ (填字母)两种试剂,再通过必要的操作即可实现。
a.NaOH溶液 b.氨水 c.CO2气 d.HNO3
②写出Na2BeO2与足量盐酸发生反应的离子方程式: ▲ 。
(3)为使Fe3+沉淀完全,须用氨水调节pH = a,则a应控制在 ▲ 的范围内;检验Fe3+是否沉淀完全的操作方法是 ▲ 。
15.(12分)全世界每年被腐蚀损耗的钢铁约占全年钢铁产量的1/10,而在潮湿空气中发生吸氧腐蚀是钢铁腐蚀的主要原因。
(1)在潮湿空气中,钢铁发生吸氧腐蚀转化为Fe(OH)2的电池反应方程式为
▲ 。
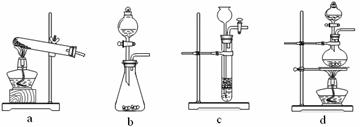 (2)已知草酸(H2C2O4)分解的化学方程式为:H2C2O4
(2)已知草酸(H2C2O4)分解的化学方程式为:H2C2O4 CO↑
+ CO2↑ + H2O,下列装置中,可用作草酸分解制取气体的是 ▲ 。(填字母)
CO↑
+ CO2↑ + H2O,下列装置中,可用作草酸分解制取气体的是 ▲ 。(填字母)
(3)某实验小组为测定铁锈样品的组成(假定铁锈中只有Fe2O3·nH2O和Fe两种成份),利用草酸分解产生的CO和铁锈反应,实验装置如下图所示。
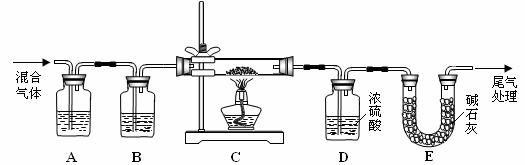
①为得到干燥、纯净的CO气,洗气瓶A、B中盛放的试剂分别是 ▲ 、
▲ 。
②在点燃酒精灯之前应进行的操作是:(a)检查装置气密性;(b) ▲ 。
③准确称量样品的质量10.00 g置于硬质玻璃管中,充分反应后冷却、称量(假设每步均完全反应),硬质玻璃管中剩余固体质量为8.32 g,D中浓硫酸增重0.72 g,则n = ▲ 。
④在本实验中,下列情况会使测定结果n偏大的是 ▲ 。(填字母)
a.缺少洗气瓶B b.缺少装置E c.反应后固体是铁和少量Fe2O3·nH2O
14.如右下图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器。当其它条件相同时,在Ⅰ、Ⅱ中分别加入2 mol X和2 mol Y,开始时容器的体积均为V L,发生如下反应并达到平衡状态(提示:物质X、Y的状态均未知,物质Z的状态为气态):
2X(?)+ Y(?) a Z(g)
a Z(g)
此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2。
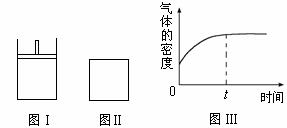 下列判断正确的是
下列判断正确的是
A.物质Z的化学计量数a = 2
B.若Ⅱ中气体的密度如图Ⅲ所示,
则X、Y中只有一种为气态
C.若X、Y均为气态,则在平衡
时X的转化率:Ⅰ>Ⅱ
D.若X为固态、Y为气态,则
Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ
非 选 择 题
13.短周期主族元素A、B、C、D的原子序数依次增大,A、B、C原子的最外层电子数之和为12,B、C、D位于同一周期,C原子的最外层电子数既是A原子内层电子数的3倍又是B原子最外层电子数的3倍。下列说法正确的是
A.元素A、C的最高价氧化物对应的水化物都是弱酸
B.元素B能与A的最高价氧化物发生置换反应
C.元素B和D能形成BD2型的共价化合物
D.D的单质有毒,且有漂白性
12.下列溶液中各微粒的浓度关系一定正确的是
A.某酸性溶液中只含NH4+、Cl-、H+、OH-四种离子,则溶液中:
c(Cl-)>c(H+)>c(NH4+)>c(OH-)
B.在Na2CO3和NaHCO3的混合溶液中:
c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.将0.1 mol CuSO4·(NH4)2SO4·6H2O溶于水配成的1 L溶液中:
c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-)
D.等体积、等浓度的NaX溶液和弱酸HX溶液的混合后的溶液中:
c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
11.某储能电池的原理如右图所示,溶液中c(H+) = 2.0 mol·L-1,阴离子为SO42-,a、b均为惰性电极,充电过程中左槽溶液颜色由蓝色变为黄色。下列叙述正确的是
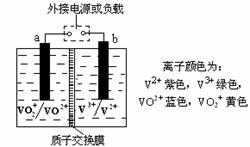 A.当右槽溶液颜色由绿色变为紫色时,
A.当右槽溶液颜色由绿色变为紫色时,
电池中能量转化形式为化学能转化
为电能
B.充电过程中,a极的反应式为
VO2+ -e- + H2O = VO2+ + 2H+
C.储能电池a、b两极间的电解质溶
液中通过电子的定向移动形成闭合
回路
D.放电时,当转移的电子数为6.02 × 1023时,共有1.0 mol H+从右槽迁移进入左槽
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com