
题目列表(包括答案和解析)
6.下列有关实验操作错误的是( )
A.用药匙取用粉末状或小颗粒状固体 B.用胶头滴管滴加少量液体
C.给盛有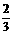 体积液体的试管加热 D.倾倒液体时试剂瓶标签面向手心
体积液体的试管加热 D.倾倒液体时试剂瓶标签面向手心
5.2007年诺贝尔化学奖得主Gerhard
Ertl对金属Pt表面催化CO氧化反应的模型进行了深入研究。下列关于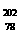 Pt的说法正确的是( )
Pt的说法正确的是( )
A.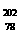 Pt和
Pt和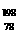 Pt的核外电子数相同,是同一种原子
Pt的核外电子数相同,是同一种原子
B.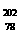 Pt和
Pt和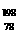 Pt的中子数相同,互称为同位素yjw
Pt的中子数相同,互称为同位素yjw
C.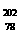 Pt和
Pt和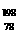 Pt的质子数相同,互称为同位素
Pt的质子数相同,互称为同位素
D.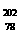 Pt和
Pt和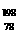 Pt的质量数不同,不能互称为同位素
Pt的质量数不同,不能互称为同位素
4.方志敏烈士在狱中曾用米汤给鲁迅先生写信,鲁迅先生收到信后,为了看清信的内容,使用的化学试剂是( )
A.硝酸银溶液 B.碘化钾淀粉试液
C.石蕊试液 D.碘酒
3.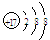
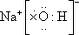 化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
A.NaOH的电子式: B.氯的原子结构示意图
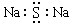 C.Na2S的电子式:
D.质量数为37的氯原子
C.Na2S的电子式:
D.质量数为37的氯原子 Cl
Cl
2.下列仪器名称正确的是 ( )
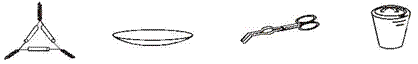
A.三脚架 B.表面皿 C.镊子 D.瓷钳锅
1.化学与能源开发、环境保护、资源利用等密切相关。下列说法错误的是( )
A.为提高农作物的产量和质量,应适量合理使用化肥和农药
B.垃圾是放错地方的资源,应分类回收利用
C.实现化石燃料清洁利用,同时需要开发新能源
D.绿色化学的核心是应用化学原理对环境污染进行治理yjw
21. (12分)(1)环境专家认为可以用铝将水中的NO3- 转化为N2 ,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH-、Al(OH)3、NO3- 、N2,请将各粒子分别填入以下空格(不用配平)。
NO3- + + → + +
该反应过程中,被氧化与被还原的元素的物质的量之比为 。
(2)若4Al(s)+3O2(g) =2 Al2O3(s) △H= a KJ/mol
Fe2O3(s)+
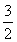 C(s)=
C(s)= 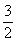 CO2(g)+2Fe(s) △H= b KJ/mol
CO2(g)+2Fe(s) △H= b KJ/mol
C(s)+O2(g)=CO2(g) △H= c KJ/mol
写出Al与氧化铁发生铝热反应的热化学方程式: 。
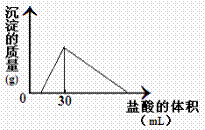
(3)将一定质量的钠铝合金置于水中,合金全部溶解,
得到20mL PH=14的溶液,然后用2mol/L的盐酸滴定,
可得到沉淀量与消耗的盐酸体积关系如图:则反应过程
中产生氢气的总体积为 L(标准状况)。
焦作市2010-2011学年(上)高三期末考试
20.(12分)如图所示3套实验装置,分别回答下列问题:
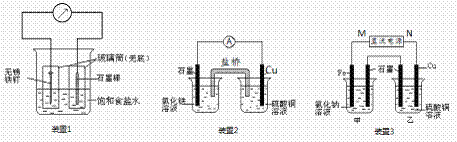
(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为 。
(2)装置2中的石墨是 极(填“正”或“负”),该装置发生的总反应的离子方程式为 。
(3)装置3中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。取出Cu电极,洗涤、干燥、称量、电极增重 0.64 g。
① 电源的M端为 极,甲烧杯中铁电极的电极反应为 ;
② 乙烧杯中电解反应的离子方程式为 ;
③ 甲、乙两烧杯中生成的气体标准状况下共 mL。
19.(10分)在一固定容积为2L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:
N2(g)+3H2(g) 2NH3(g) △H <0
2NH3(g) △H <0
(1)该反应450℃的平衡常数 500℃时的平衡常数(填“>”、“<”或“=”);
(2)下列描述中能说明上述反应已达平衡的是
a.3v正(H2)=2v逆(NH3) b.容器中气体的平均相对分子量不随时间而变化
c.容器中气体的密度不随时间而变化 d.容器中气体的分子总数不随时间而变化
(3)上述反应若第5分钟时达到平衡,测得NH3的物质的量为0.2mol
计算从反应开始到平衡时,平均反应速率v(N2)为 mol/(L·min)
(4)保持其他条件不变,若初始投入量为a molN2、b molH2 、c molNH3,也可得到与上述相同的平衡,则a、b、c需满足关系式: ;
(5)第5分钟末,保持其它条件不变, 若继续通入0.2 mol的N2和0.6 mol的H2,
则平衡 移动(填“向正反应方向”“向逆反应方向”或“不”)。
18.(8分)现有A、B、C、D、E五种强电解质,他们在水中可电离产生下列离子(每种电解质电离时只产生一种阳离子,而且不重复)。
|
阳离子 |
H+、Na+、Al3+、Ag+、 Ba2+ |
|
阴离子 |
OH-、 Cl-、CO32-、NO3-、SO42- |
已知:①A、B两溶液呈碱性; C、D、E溶液呈酸性。
②向E溶液中逐滴滴加B溶液至过量,沉淀量先增加后减少但不消失。
③D溶液与另外四种溶液反应都能产生沉淀。
试回答下列问题:
(1)A溶液呈碱性的原因是(用离子方程式表示) ;
(2)写出E溶液与过量B溶液反应的离子方程式 ;
(3)若25℃时C、E溶液PH=4,则E溶液中水电离出的氢离子浓度是C溶液中水电离出的氢离子浓度的 倍;
(4)将C溶液逐滴加入等体积、等物质的量浓度的A溶液中反应后溶液中的一价(+1和-1)离子浓度由大到小的顺序为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com