
题目列表(包括答案和解析)
27.海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
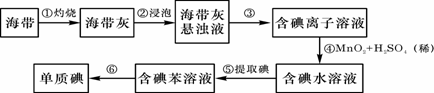
(1) 从上述步骤中可知,海带中含有的碘元素的主要存在形式是 。
(2) 步骤①灼烧海带时,除需要三脚架、泥三角外,还需要用到的实验仪器是 。
(3) 步骤④中的转化还可以Cl2或双氧水,请分别写出反应的离子方程式:
、 。
(4) 步骤⑥是从含碘苯溶液中分离出单质碘和回收苯,还需经过蒸馏,指出
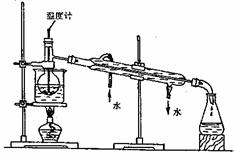 下列实验装置中的错误之处。
下列实验装置中的错误之处。
①
②
进行上述蒸馏操作时,使用水浴的
原因是 、
______________________________,
最后晶态碘在 里聚集。
26.现有m g某气体,它由双原子分子构成,它的摩尔质量为M g·mol-1。若阿伏加德罗常数用NA表示,则该气体的物质的量为 mol,该气体所含原子总数为 个,在标准状况下该气体的体积为 L。若该气体不与水反应,将其溶于1L水中,所得溶液中溶质的质量分数为 ,该气体溶于水后形成VL溶液,其溶液的物质的量浓度为 mol/L。
25.1811年法国化学家库特瓦用硫酸处理海藻灰时发现了碘。碘单质通常状况下为_______色固体,其制剂可用来消毒和治疗甲状腺肿。碘缺乏病是目前已知的导致人类智力障碍的主要原因,因此碘元素称作“智慧元素”。碘的单质有两种特性,一是物理特性:_____________________;二是化学特性:____________________________。
1824年法国化学家巴拉尔用氯气处理提取食盐后的盐水母液时发现了溴。溴元素的99%存在于海洋,称作“海洋元素”,其化合物可用作镇静剂。溴的原子序数为35,其原子结构简图为________________;溴化钠中存在的化学键是____________,在物理性质上表现出_______________________。氯化钠的电子式为_________,溴化钠的电离方程式为_________________ 。检验某固体试样中是否有Br-的方法为____________
_______________________________________________________。
24.(1)用滴管将新制的饱和氯水逐滴滴入含酚酞的氢氧化钠的稀溶液中,当滴到最后一滴时,红色突然褪去。产生该现象的原因可能有两个:
①是由于__________________________________________________;
②是由于__________________________________________________。
用实验证明红色褪去的原因是①或者是②,其方法是:______________________
_______________________________________。
(2)在一定条件下氯气可与氯化铵发生反应:xCl2+yNH4Cl→yNCln+(x+y)HCl
当消耗6.72 L标准状况下的氯气时,生成0.10 mol氮的氯化物,则此氮的氯化物的化学式为________。
23.某元素M的原子核内质子数与中子数相等,它形成气态氢化物在标准状况下的密度是1.518g/L,该氢化物0.5mol充分燃烧,生成9g水,则M的元素符号为 ,原子序数是 ,原子结构示意图为 ,M的阴离子电子层结构与____________等微粒相同。
22.20℃时有a g硫酸铜溶液V mL,将溶液蒸发掉b g水后恢复到20℃,恰好全部生成硫酸铜晶体(CuSO4·5H2O),则下列关系式错误的是( )
A.原硫酸铜溶液的密度为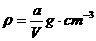
B.生成硫酸铜晶体的物质的量为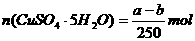
C.原硫酸铜溶液的物质的量浓度为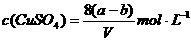
D.原硫酸铜溶液的质量分数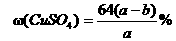
21.元素X与Y组成A、B两种化合物,A中X的质量占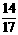 ,B中X的质量占
,B中X的质量占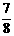 ,则化合物A和B的分子式分别是 ( )
,则化合物A和B的分子式分别是 ( )
A.XY和XY2 B.X2Y和X2Y3 C.XY2和X2Y D.XY3和X2Y4
20.氯的原子序数为17,35Cl是氯的一种同位素,下列说法正确的是( )
A.35Cl原子所含质子数为18
B.1 mol的1H35Cl分子所含中子数约为19×6.02×1023
C.3.5 g的35Cl2气体的体积为2.24 L
D.35Cl2气体的摩尔质量为70 g·mol-1
19. 科学家在研究化学物质时,常常对物质进行分类,以便对同类物质的组成和性能进行深入的研究。下列4组物质:①Mg、O2 、N2、NO;②NaOH、Na2CO3、CH4、KCl;③H2CO3、H2SO4、NH3·H2O、H2SiO3;④CaO、SO2 、CO2、SiO2。从物质的基本分类看,每组中都有一种物质与其它物质不属于同一类,这4种物质分别是( )
A.Mg、Na2CO3、H2CO3、CaO B.O2、NaOH、H2SO4、SiO2
C.NO、CH4、NH3·H2O、CaO D.NO、KCl、H2SiO3、SO2
18. 核内中子数为N的R2+离子,质量数为A,则ng它的氧化物中所含质子的物质的量为( )
A.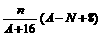 mol B.
mol B.  mol
mol
C. (A-N+2)mol D. 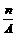 mol
mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com