
题目列表(包括答案和解析)
16. 18.(10分)2010年亚运会在我国广州成功举办,整个亚运会体现了环保理念。
(1)广州亚运会火炬“潮流”采用了丙烷(C3H8)作为燃料,燃烧后的产物为水和二氧化碳。在298K时,1mol丙烷完全燃烧生成CO2和液态水放出2221.5kJ的热量,则该反应的热化学方程式为 。
又知:在298K时C3H8(g)=C3H6(g)+H2(g)△H=124.2 kJ·mol-1,
H2(g)+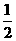 O2(g)=H2O(I) △H= -285.8kJ·mol-1,
O2(g)=H2O(I) △H= -285.8kJ·mol-1,
则l mo1C3H6完全燃烧生成CO2和液态水时放出的热量是______kJ。
(2)广州是一座美丽的海滨城市,海水资源非常丰富。
①海洋电池是以铝为负极,铂网为正极,海水为电解质溶液,空气中氧气与铝反应产生电流,电池总反应为4Al+3O2+6H2O=4Al(OH)3,下列说法正确的是____(填写序号字母);
a.电池工作时,电流由铝电极沿导线流向铂电极
b.铂电极采用网状比块状更利于O2放电
c.海水中的OH-向铝电极方向移动
②用惰性电极电解200mL l.5mol/L食盐水;电解2min时,两极共收集到448mL气体(标准状况下).写出该电解反应的离子方程式 。假设电解前后溶液的体积不变,则电解后该溶液的pH为____。
17.(12分)A 、B-、C、D、E、F都是含有18个电子的微粒(分子或单核离子),请回答:
(1)A是单原子分子,则A的原子结构示意图是 ;
(2)B的最高价氧化物对应的水化物的化学式为 ;
(3)C是由两种元素组成的三原子分子,其存在的共价键类型为 ;
(4)D是所有18个电子的微粒中氧化能力最强的分子,其分子式是 ;
(5)E是由两种元素组成的四原子分子,其分子式为 或 ;
(6)F分子含有8个原子,其结构简式为 。
16.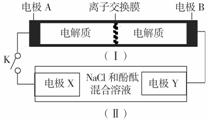 下图装置(Ⅰ)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池充、放电的化学方程式为:2K2S2+KI3
下图装置(Ⅰ)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池充、放电的化学方程式为:2K2S2+KI3 K2S4+3KI。装置(Ⅱ)为电解池的示意图。当闭合开关K时,X附近溶液先变红。则下列说法正确的是( )
K2S4+3KI。装置(Ⅱ)为电解池的示意图。当闭合开关K时,X附近溶液先变红。则下列说法正确的是( )
A.闭合K时,K+从右到左通过离子交换膜
B.闭合K时,A的电极反应式为:3I--2e-===I
C.闭合K时,X的电极反应式为:
2Cl--2e-===Cl2↑
D.闭合K时,当有0.1 mol K+通过离子交换膜,X电极上产生标准状况下气体1.12 L
II卷(非选择题 52分)
15.高铁酸钾(K2FeO4)是一种既能杀菌、消毒、又能絮凝净水的水处理剂。工业制备高铁酸钾的反应离子方程式为
Fe(OH)3 + C1O-+ OH-→ FeO42-+ C1-+ H2O(未配平)
下列有关说法不正确的是( )
A.由上述反应可知,Fe(OH)3的氧化性强于FeO42-
B.高铁酸钾中铁显+6价
C.上述反应中氧化剂和还原剂的物质的量之比为3 :2
D.K2FeO4处理水时,不仅能消毒杀菌,而且生成的Fe3+水解形成Fe(OH)3胶体能吸附水中的悬浮杂质
14.水的电离平衡曲线如右图所示,下列说法不正确的( )
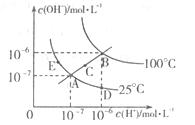 A.图中五点Kw间的关系:B>C>A=D=E
A.图中五点Kw间的关系:B>C>A=D=E
B.若从A点到D点,可采用在水中加入少
量酸的方法
C.若从A点到C点,可采用温度不变时在
水中加入适量NH4C1固体的方法
D.若处在B点时,将pH=2的硫酸溶液与pH=10的KOH溶液等体积混合,所得溶液呈中性
13.室温下某无色透明溶液中由水电离出的H+和OH-浓度的乘积为1×10-24,则此溶液中可能大量共存的离子组为( )
A.HCO3-、Al3+、Na+、SO42- B.I-、NO3-、K+、NH4+
C.MnO4-、Cl-、SO42-、K+ D.SiO32-、OH-、SO32-、Na+、Cl-
12.现有100mLMgCl2和AlCl3的混合溶液,其中c(Mg2+)=0.2mol·L-1,
c(Cl-)=1.3 mol·L-1.要使Mg2+完全转化为Mg(OH)2且与Al3+恰好分开,至少需要2 mol·L-1的NaOH溶液的体积为 ( )
A.80 mL B.100 mL C.120 mL D.140 mL
11.能正确表示下列反应相应的离子方程式是( )
A.将Fe(OH)3溶于HI溶液中:Fe(OH)3+3H+=Fe3++3H2O
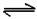 B.NaHCO3溶液水解:HCO3-+H2O CO32-+H3O+
B.NaHCO3溶液水解:HCO3-+H2O CO32-+H3O+
C.用硫酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:
2MnO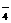 +
6H+ + 5H2O2 = 2Mn2+ + 5O2↑
+ 8H2O
+
6H+ + 5H2O2 = 2Mn2+ + 5O2↑
+ 8H2O
D.铁跟盐酸反应 2Fe + 6H+=2Fe3++3H2↑
10.下述实验不能达到预期实验目的的是( )
|
序号 |
实验内容 |
实验目的 |
|
A |
将2.5g CuSO4·5H2O溶解在97.5g 水中 |
配制质量分数为1.6%的CuSO4溶液 |
|
B |
向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 |
说明一种沉淀能转化为另一种更难溶的沉淀 |
|
C |
室温下,用pH试纸测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH |
比较HClO和CH3COOH的酸性强弱 |
|
D |
室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 |
研究浓度对反应速率的影响 |
9.某温度下,CO2饱和溶液的浓度是0. 03mol·L-1,其中1/3的 CO2转变为H2CO3,而H2CO3仅有0.1%发生如下电离:H2CO3 H++HCO3-,则溶液的pH约为( )
H++HCO3-,则溶液的pH约为( )
A.3 B. 4 C.5 D.6
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com