
题目列表(包括答案和解析)
5.设NA为阿伏伽德罗常数的值,下列叙述正确的是
A.1mol羟基与17gNH3所含电子数都为NA
B.12.4g白磷(分子式为P4)中含有P-P共价键0.6 NA
C.电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g
D.适量铜粉溶解于1L0.5mol·L-1稀硝酸中,当生成2.24LNO时,溶液中氮原子数为0.4 NA
4.下列说法不正确的是
A.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
B.工业上用石灰乳对煤燃烧后形成的烟气进行脱硫,最终能制得石膏
C.现代常用红外光谱仪、核磁共振仪研究有机化合物的结构
D.MgO、Al2O3的熔点很高,工业上用于制作耐高温材料,也用于冶炼镁、铝金属
3.下列离子方程式书写正确的是
A.金属铝溶于氢氧化钠溶液: Al+2OH-=AlO2-+H2↑
B.Cl2溶于水: Cl2+H2O=2H++Cl-+ClO-
C.Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-=5SO42-+2Mn2++3H2O
D.NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
2.氯化钠是一种重要的化工原料。下列表述中正确的是
A.NaCl的电子式为 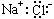
B.电解熔融氯化钠可得到氯气和金属钠
C.23Na37Cl中质子数和中子数之比是8:7
D.由NaCl制备纯碱时发生了氧化还原反应
1.化学与能源、环境、生产、生活密切相关,下列说法不正确的是
A.世博会很多场馆的外壳使用非晶硅薄膜,以充分利用太阳能,体现低碳经济
B.世博停车场安装催化光解设施,可将汽车尾气中CO和NOx反应生成无毒气体
C.利用工业生产产生的二氧化碳可制造全降解塑料
D.用K2FeO4取代Cl2处理饮用水,有杀菌消毒作用,且不会形成致癌物,但无净水作用
(三)印刷电路铜板腐蚀剂常用FeCl3。腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤① ② ③过滤。(提供的药品:
Cl2 浓H2SO4 NaOH溶液 CuO Cu)
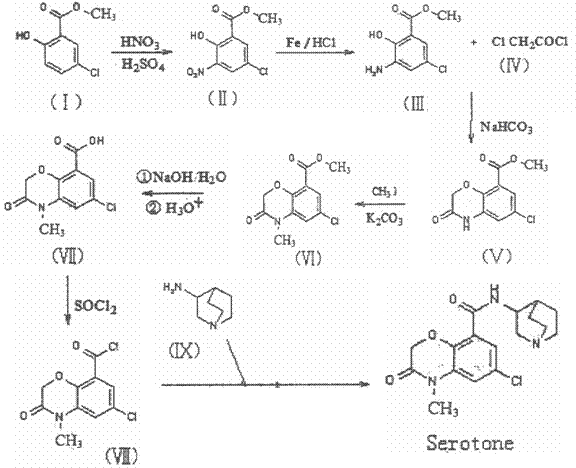
19.(12分)苏罗同(Serotone)是一种镇吐药,其合成路线如下(在下一页):
(1)化合物Ⅰ的核磁共振氢谱有 峰。
(2)化合物Ⅱ中含氧官能团有 (任意写出两个)。
(3)Ⅲ+Ⅳ→Ⅴ中NaHCO3与Ⅴ→Ⅵ中K2CO3的主要作用是 。
(4)写出下列反应的类型:
①Ⅱ→Ⅲ ,②Ⅷ→Serotone 。
(5)已知:①当苯环上有-OH、-NH2、甲基时,苯环上再引入基团时进入其邻、对位;当苯环上有-COOH、-NO2、-SO3H时,苯环上再引入基团时进入其间位。
②苯胺具有弱碱性,易被强氧化剂氧化。
③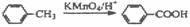 。
。
试画出以甲苯和乙醇为原料合成苯唑卡因(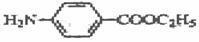 )的合成路线流程图(必要条件需注明,无机试剂任选)。合成路线流程图示例如下:
)的合成路线流程图(必要条件需注明,无机试剂任选)。合成路线流程图示例如下:
20.(12分)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为: CO (g) + 2H2(g)  CH3OH (g) △H 1 (反应1)
CH3OH (g) △H 1 (反应1)
该反应的原料CO和H2本身都可作为燃料提供动力,两种物质燃烧的热化学方程式为:
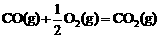 △H2=-283 kJ·mol-1 (反应2)
△H2=-283 kJ·mol-1 (反应2)
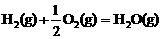 △H3=-242 kJ·mol-1 (反应3)
△H3=-242 kJ·mol-1 (反应3)
某些化学键的键能数据如下表:
|
化学键 |
C-C |
C-H |
H-H |
C-O |
C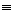 O O |
H-O |
|
键能/kJ·mol-1 |
348 |
413 |
436 |
358 |
1072 |
463 |
请回答下列问题:
(1)反应1的焓变△H1= 。
(2)CH3OH (g)燃烧生成CO2(g)和H2O(g)的热化学方程式为:
CH3OH(g)+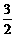 O2(g)
== CO2(g)+2H2O(g) △H4 该反应的焓变△H4=
。
O2(g)
== CO2(g)+2H2O(g) △H4 该反应的焓变△H4=
。
与CO和H2相比,甲醇作为汽车动力燃料的优点是 。
(3)反应1的平衡常数表达式为 。
为提高甲醇的产率,可以采取的措施有
(写出3点)。既能提高产率,又能提高反应速率的措施是 。
(4)甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,该燃料电池的电池反应式为:CH3OH(l)+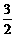 O2(g)
== CO2(g)+2H2O(l)。其工作原理示意图如下:
O2(g)
== CO2(g)+2H2O(l)。其工作原理示意图如下:
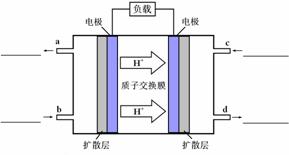
①在上图的横线上标出a、b、c、d四个出入口通入或排出的物质名称(或化学式)
②负极的电极反应式为 。
选修一--物质结构
21.(12分)下表为长式周期表的一部分,其中的编号代表对应的元素。
|
① |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
② |
|
③ |
|
|
|
|
④ |
|
|
|
|
|
|
|
|
|
|
⑤ |
|
|
⑥ |
⑦ |
|
|
|
⑧ |
|
|
|
|
|
|
|
⑨ |
⑩ |
|
|
|
|
|
|
|
请回答下列问题:
(1)表中属于d区的元素是 (填编号)。
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如右图(图中②- 、④-
、④- 、⑨-
、⑨-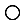 ),则该化合物的化学式为 (用元素符号表示)。
),则该化合物的化学式为 (用元素符号表示)。
 (3)某元素的基态特征电子排布式为nsnnpn+1,该元素原子的核外 最外层电子的孤对电子数为
;该元素与元素①形成的分子
X构形为 ,X在①与③形成的分子Y中的溶解度很大, 其主要原因是
。X分子中中心原子为
杂化。
(3)某元素的基态特征电子排布式为nsnnpn+1,该元素原子的核外 最外层电子的孤对电子数为
;该元素与元素①形成的分子
X构形为 ,X在①与③形成的分子Y中的溶解度很大, 其主要原因是
。X分子中中心原子为
杂化。
侯集中学2010年第一学期高三化学期末模拟考试卷
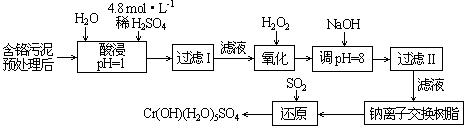
(二)某工厂对制革工业污泥中Cr(III)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+):
部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
|
阳离子 |
Fe3+ |
Fe2+ |
Mg2+ |
Al3+ |
Cu2+ |
Cr3+ |
|
开始沉淀时的pH |
1.9 |
7.0 |
-- |
-- |
4.7 |
-- |
|
沉淀完全时的pH |
3.2 |
9.0 |
11.1 |
8 |
6.7 |
9 (>9溶解) |
(1)实验室用18.4 mol·L-1的浓硫酸配制250 mL 4.8 mol·L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种能精确量取一定体积液体的仪器)外,还需 。
(2)酸浸时,为了提高浸取率可采取的措施是 (至少一条)。
(3)加入H2O2的作用是 。
(4)钠离子交换树脂的原理为:Mn++nNaR → MRn+nNa+,被交换的的杂质离子是
(选填:Fe3+、Al3+、Ca2+、Mg2+)。
(一)染料工业排放的废水中含有大量有毒的NO2¯,可以在碱性条件下加入铝粉除去(加热处理后的废水,会产生能使湿润的红色石蕊试纸变蓝的气体)。除去NO2¯的离子方程式为 。
1.下列化学用语使用正确的是
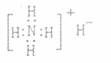
A.NH4H的电子式: B.丙烷分子的球棍模型
C.CO2的比例模型: D.原子核内有10个中子的氧离子:
D.原子核内有10个中子的氧离子: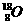
2.下列实验操作能够达到目的的是
A.用金属钠除去乙醇中混有的少量水
B.用激光笔鉴别Fe(OH)3胶体和Fe(SCN)3溶液
C.用足量铁粉和氯气直接反应制FeCl2固体
D.用铂丝蘸取某溶液于无色火焰上灼烧,火焰呈黄色,证明其中不含K+
3.下列有关金属的说法中,正确的是
①纯铁不容易生锈 ②钠着火用水扑灭 ③铝在空气中耐腐蚀,所以铝是不活泼金属 ④缺钙会引起骨质疏松,缺铁会引起贫血 ⑤青铜、不锈钢、硬铝都是合金 ⑥ KSCN溶液可以检验Fe3+离子
A.①④⑤⑥ B.②③④⑤ C.①③④⑤ D.①②⑤⑥
4.工业上利用氢气在氯气中燃烧,所得产物再溶于水的方法制盐酸,流程复杂且造成浪费。
有人设想利用原电池原理直接制备盐酸的同时,获取电能,假设这种想法可行,下列说法错误的是 ( )
A.两极材料都用石墨,用稀盐酸作电解质溶液
B.通入氢气的电极为原电池的正极
C.电解质溶液中的阳离子向通入氯气的电极移动
D.通氯气的电极反应为Cl2+2e-===2Cl-
5. 在一定条件下,对于反应mA(g)+nB(g) 碱 cC(g)+dD(g),C物质的浓度(c%)与温度、
在一定条件下,对于反应mA(g)+nB(g) 碱 cC(g)+dD(g),C物质的浓度(c%)与温度、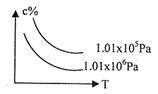 压强的关系如图所示,下列判断正确的是( )
压强的关系如图所示,下列判断正确的是( )
A.△H<0 △S>0
B.△H>0 △S<0
C.△H>0 △S>0
D.△H<0 △S<0
6.在给定条件的水溶液中一定能大量共存的离子组是
A.能与Al反应生成H2的溶液:Ca2+、NH4+、HCO3-、Cl-
B.c(Fe2+)=0.05mol/L的溶液:H+、Na+、NO3-、SO42-
C.H+、Mg2+、Cl-、NO3-
D.由水电离出的c(H+)=10-12mol/L的溶液:K+、Ba2+、ClO-、CO32-
7.用下列装置不能达到有关实验目的的是

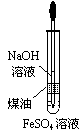

甲 乙 丙 丁
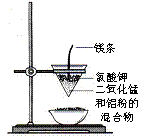
A.用甲图装置电解精炼铝 B.用乙图装置制备Fe(OH)2
C.用丙图装置制取金属锰 D.用丁图装置比较NaHCO3和Na2CO3的热稳定性
不定项选择题(本题包括7小题,每小题4分,共28分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分。)
8.下列离子方程式书写正确的是 ( )
A.将碳与浓硫酸共热反应后的气体混合物通入过量氢氧化钠溶液中
CO2+SO2+4OH-=SO2-3+CO2-3+2H2O
B.NaHSO4溶液与Ba(OH)2溶液反应至中性:
H++SO42-+Ba2++OH- = BaSO4↓+H2O
C.向Fe(NO3)3溶液中加入过量的HI溶液
2NO-3+8H++6I-=3I2+2NO↑+4H2O
D.将等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合
HCO-3+Ba2++OH-=BaCO3↓+H2O
9.甲、乙、丙、丁4种物质分别含2种或3种元素,它们的分子中各含18个电子。甲是气态氢化物,在水中分步电离出两种阴离子。下列推断合理的是
A.某溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应
B.乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键
C.丙中含有第二周期IVA族的元素,则丙一定是甲烷的同系物
D.丁和甲中各元素质量比相同,则丁中一定含有-1价的元素
10.设NA为阿伏加德罗常数的值,下列说法中正确的是
A.1mol乙基中含有的电子数为17NA
B.标准状况下,22.4L一氯甲烷中共价键数目为4NA
C.标准状况下,2.24 LCl2完全被NaOH溶液吸收,转移的电子数为0.2NA
D.6.4gCaC2晶体中含有阴阳离子总数为0.3NA
11.已知25℃时有关弱酸的电离平衡常数:
|
弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
|
电离平衡常数(25℃) |
1.8×l0_5 |
4.9×l0_10 |
K1=4.3×l0_7 K2=5.6×l0_11 |
则下列有关说法正确的是
A.等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa)
B.a mol·L-1 HCN溶液与b mol·L-1 NaOH溶液等体积混合,所得溶液中
c(Na+)>c(CN-),则a一定小于b
C.冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离度、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+ c(H+)=c(OH-)+ c(HCO3-) +2c(CO32-)
12.羟基扁桃酸是药物合成的重要中间体,它可由苯酚和乙醛酸反应制得。
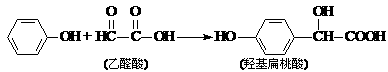
下列有关说法正确的是学
A.苯酚和羟基扁桃酸互为同系物
B.常温下,1mol羟基扁桃酸只能与1mol Br2反应
C.乙醛酸的核磁共振氢谱中只有1个吸收峰
D.羟基扁桃酸分子中至少有12个原子共平面
13.在恒温恒容的密闭容器中,发生反应3A(g)+B(g)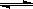 xC(g)。Ⅰ、将3molA和2molB在一定条件下反应,达平衡时C的体积分数为a;Ⅱ、若起始时A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a。下列说法正确的是
xC(g)。Ⅰ、将3molA和2molB在一定条件下反应,达平衡时C的体积分数为a;Ⅱ、若起始时A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a。下列说法正确的是
A.若Ⅰ达平衡时,A、B、C各增加1mol,则B的转化率将一定增大
B.若向Ⅰ平衡体系中再加入3molA和2molB,C的体积分数若大于a,可断定x>4
C.若x=2,则Ⅱ体系起始物质的量应当满足3 n(B) =n(A)+3
D.若Ⅱ体系起始物质的量,当满足3 n(C) +8n(A)==12 n(B)时,可判断x=4
14.下表是五种银盐的溶度积常数(25℃):
|
化学式 |
AgCl |
Ag2SO4 |
Ag2S |
AgBr |
AgI |
|
溶度积 |
1.8×10-10 |
1.4×10-5 |
6.3×10-50 |
7.7×10-13 |
8.51×10-16 |
下列说法错误的是 ( )
A.五种物质在常温下溶解度最大的是Ag2SO4
B.将氯化银溶解于水后,向其中加入Na2S,则可以生成黑色沉淀
C.氯化银、溴化银和碘化银三种物质在常温下的溶解度随着氯、溴、碘的顺序增大
D.沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动
第Ⅱ卷 非选择题(共78分)
15、(10分)市面上一些很白的粉条,可能是经过SO2漂白的食品,这种粉条食用后对人体有危害。
某化学兴趣小组的同学通过下列方法对疑似用SO2漂白的粉条中残留的SO2含量进行研究:
实验课题:粉条中残留SO2的定量测定
实验原理:5SO2+2KMnO4+2H2O=2MnSO4+K2SO4+2H2SO4
2KMnO4+5Na2SO3+3H2SO4=2MnSO4+K2SO4+5Na2SO4+3H2O
操作流程:安装蒸馏、吸收装置→SO2的产生与吸收→转移褪色→Na2SO3标准溶液滴定
实验装置: C中盛有200 g粉条;D、E、F各盛装1.00 mL浓度为1.00×10-3mol/L的KMnO4溶液(H2SO4酸化)。
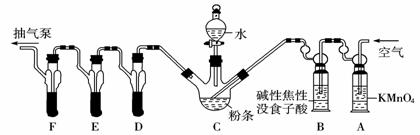
请回答下列有关问题:
(1)实验时要对C装置进行加热,其目的是____________________。
(2)检查上述装置气密性的方法是__________________________ 。
(3)实验过程中,用抽气泵抽气的目的是_________________________。
(4)A中盛装KMnO4溶液是为了除去空气中可能含有的____________;B中盛装碱性焦性没食子酸溶液的作用是______________________;如去除B装置,则实验中测得的SO2含量将____________。
(5)收集D、E、F所得吸收液,并洗涤D、E、F,将吸收液、洗涤液一并置于锥形瓶中,加水稀释至25 mL,用浓度为5×10-4mol/L Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液11.00 mL,则该粉条中硫化物(以SO2计)的含量为____________mg/kg.
16.(10分)为检验浓硫酸与木炭在加热条件下反应产生的SO2和CO2气体,设计了如图所示实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用I2和淀粉的蓝色溶液浸湿的脱脂棉。
请回答下列问题:
|

(1)装置A、D中发生反应的化学方程式为
; 。
(2)实验前欲检查装置A的气密性,可以采取的操作是 ;
(3)此实验成败的关键在于控制反应产生气体的速率不能过快,因此设计了虚框部分的装置,则正确的操作顺序是 (用操作编号填写)
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水夹b;
(4)实验时,装置C中的现象为 ;
(5)当D中产生 现象时,可以说明使E中澄清石灰水变浑浊的是CO2,而不是SO2;
(6)装置D的作用为 。
17.(10分)江苏有着丰富的海水资源,海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、
SO42-、Br-、CO32-、HCO3-等离子。合理利用资源和保护环境是我省可持续发展的重要保证。
⑴海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料。试写出由无水氯化镁制取金属镁的化学反应方程式 。
⑵某化工厂生产过程中会产生含有Cu2+和Pb2+的污水。排放前拟用沉淀法除去这两种离子,根据下列数据,你认为投入 (选填“Na2S”或“NaOH”)效果更好。
|
难溶电解质 |
Cu(OH)2 |
CuS |
Pb(OH)2 |
PbS |
|
Ksp |
4.8×10-20 |
6.3×10-36 |
1.2×10-15 |
1.0×10-28 |
 ⑶火力发电在江苏的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题。利用海水脱硫是一种有效的方法,其工艺流程如下图所示:
⑶火力发电在江苏的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题。利用海水脱硫是一种有效的方法,其工艺流程如下图所示:
①天然海水的pH≈8,试用离子方程式解释天然海水呈弱碱性的原因 (任写一个)。
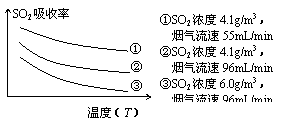 ②某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,进行了天然海水吸收含硫烟气的模拟实验,实验结果如右图所示。
②某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,进行了天然海水吸收含硫烟气的模拟实验,实验结果如右图所示。
请你根据图示实验结果,就如何提高一定浓度含硫烟气中SO2的吸收效率,提出一条合理化建议: 。
③天然海水吸收了含硫烟气后会溶有H2SO3、HSO3-等分子或离子,氧气氧化的化学原理是 (任写一个化学方程式或离子方程式)。氧化后的“海水”需要引入大量的天然海水与之混合后才能排放,该操作的主要目的是 。
18.(12分)利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。
16。
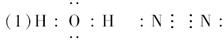 (4分 )
(4分 )
(2)⑤⑥⑦(3分)
(3)Mg3N2 AgN3 (4分 )
(4)Ag+2HNO3(浓)===AgNO3+NO2↑+H2O (2分)
(5)5:7 (2分 )
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com