
题目列表(包括答案和解析)
4、下列说法不正确的是 A.“低碳生活”有利于减缓全球气候变暖和环境恶化的速度 B.光导纤维的主要材料是二氧化硅 C.云、雾、烟均能产生丁达尔现象 D.硫酸、纯碱、硝酸钠和生石灰分别属于酸、碱、盐和氧化物
3、设NA代表阿伏加德罗常数,下列说法正确的是 A.常温常压下,氧气和臭氧的混合物16g中约含有NA个氧原子 B.标准状况下,11.2 LH2O2中含分子数为0.5NA C.标准状况下,22.4 LH2中含中子数为2NA D.100mL0.1mol·L-1的FeCl3溶液中含有Fe3+的个数为0.01 NA
2、下列有关海水资源综合利用的说法正确的是 ①蒸馏法是海水淡化的方法之一 ②海水蒸发制海盐的过程中只发生化学变化 ③从海带提取碘单质的过程涉及氧化还原反应 ④只需经过物理变化就可以从海水中得到钾单质 ⑤海水提溴涉及的反应类型包括复分解反应 A.①③ B.④⑤ C.①②③ D.①②⑤
1、从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平。下图表示了三种金属被人类开发利用的大致年限,之所以有先后,主要取决于
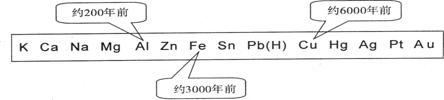 A.金属的化合价高低 B.金属的导电性强弱
C.金属的活动性大小 D.金属在地壳中的含量多少
A.金属的化合价高低 B.金属的导电性强弱
C.金属的活动性大小 D.金属在地壳中的含量多少
21.(10分)硫酸钙是一种用途非常广泛的产品。
(1)25℃时,Ksp(CaSO4)=7.10×10-5。在1L0.1mol·L-1CaCl2溶液中加入1L0.2mol·L-1的Na2SO4溶液,充分反应后(假设混合后溶液的体积变化忽略不计)溶液中Ca2+物质的量的浓度为 mol·L-1。
(2)某校课外活动小组为测定已部分脱水的生石膏的组成(xCaSO4·yH2O),做如下实验:将固体放在坩埚中加热,经测量剩余固体质量随时间变化如图所示。
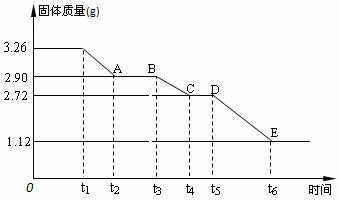
① x :y =_________。
② t2-t3时间段固体的化学式为 。
③ t5-t6时间段固体质量减轻的原因是产生了两种气体,其中一种能使品红溶液褪色,则该时间段所发生反应的化学方程式为 。
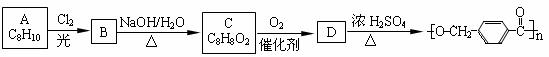
20.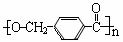 (14分)分子式为C8H10有机物A与氯气反应生成产物有多种,产物之一B可发生下列转化合成聚酯类高分子材料
,其合成路线如下:
(14分)分子式为C8H10有机物A与氯气反应生成产物有多种,产物之一B可发生下列转化合成聚酯类高分子材料
,其合成路线如下:
已知:① 同一碳原子上连两个羟基时结构不稳定,易脱水生成醛或酮:
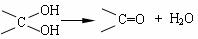
② 物质C可发生银镜反应。
请根据以上信息回答下列问题:
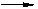 (1)A B的反应类型是 。
(1)A B的反应类型是 。
(2)由B生成C的化学方程式为 ;
(3)D的结构简式为 ,D有多种同分异构体,其中含有苯环且水解产物之一为乙酸的有______种,写出其中的一种结构简式: 。
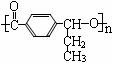
 (4)格氏试剂在有机合成方面用途广泛,可用于卤代烃和镁在醚类溶剂中反应制得。设R为烃基,已知:
(4)格氏试剂在有机合成方面用途广泛,可用于卤代烃和镁在醚类溶剂中反应制得。设R为烃基,已知:
R-X+Mg R-Mg X(格氏试剂)
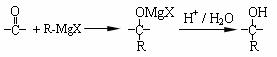
利用C物质和格氏试剂可合成另一种高分子化合物 。
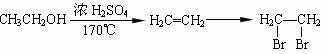
(合成路线流程图示例: )
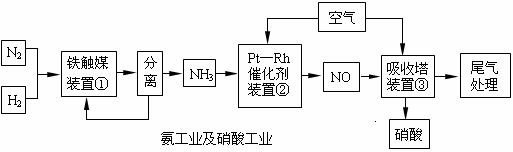
19.(12分)工业合成氨与制备硝酸一般可连续生产,流程如下:
完成下列问题:
Ⅰ.合成氨
(1)写出装置①中发生反应的化学方程式: 。
(2)已知在一定的温度下进入装置①的氮、氢混合气体与从合成塔出来的混合气体压强之比为5:4,则氮的转化率为 。
Ⅱ.氨的接触氧化原理
(3)在900℃装置②中反应有:
4NH3(g)
+ 5O2(g)  4NO(g)+ 6H2O(g);△H=-905.5
kJ·mol-1 K1=1×1053 (900℃)
4NO(g)+ 6H2O(g);△H=-905.5
kJ·mol-1 K1=1×1053 (900℃)
4NH3(g)
+ 4O2(g) 4N2O(g) + 6H2O(g);△H=-1103
kJ·mol-1 K2=1×1061 (900℃)
4N2O(g) + 6H2O(g);△H=-1103
kJ·mol-1 K2=1×1061 (900℃)
4NH3(g) +
3O2(g) 2N2(g)
+ 6H2O(g);△H=-1267 kJ·mol-1 K3=1×1067
(900℃)
2N2(g)
+ 6H2O(g);△H=-1267 kJ·mol-1 K3=1×1067
(900℃)
除了上列反应外,氨和一氧化氮相互作用:
4NH3(g)+6NO(g) 5N2(g)+6H2O(g);△H=-1804 kJ·mol-1,还可能发生氨、一氧化氮的分解。
5N2(g)+6H2O(g);△H=-1804 kJ·mol-1,还可能发生氨、一氧化氮的分解。
完成热化学方程式:2NO(g) N2(g)
+O2(g);△H=
。
N2(g)
+O2(g);△H=
。
(4)铂-铑合金催化剂的催化机理为离解和结合两过程,如下图所示:
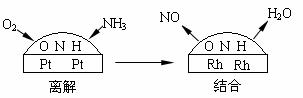
由于铂对NO和水分子的吸附力较小,有利于氮与氧原子结合,使得NO和水分子在铂
表面脱附,进入气相中。若没有使用铂-铑合金催化剂,氨氧化结果将主要生成_ __。说明催化剂对反应有_______________。
(5)温度对一氧化氮产率的影响
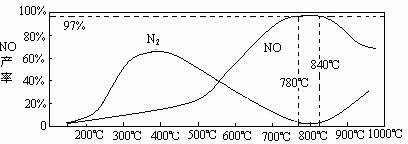
当温度大于900℃时,NO的产率下降的原因_________________(选填序号)。
A.促进了一氧化氮的分解
B.促进了氨的分解
C.使氨和一氧化氮的反应平衡移动,生成更多N2
(6)硝酸工业的尾气常用Na2CO3溶液处理,尾气的NO、NO2可全部被吸收,写出用Na2CO3
溶液吸收的反应方程式
18.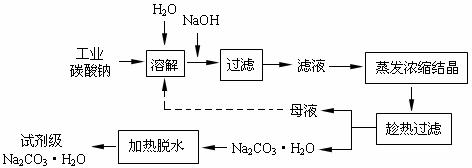 (12分)工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺线路如下:
(12分)工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺线路如下:

Ⅰ、碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:
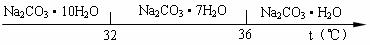
Ⅱ、25℃时有关物质的溶度积如下:
|
物质 |
CaCO3 |
MgCO3 |
Ca(OH)2 |
Mg(OH)2 |
Fe (OH)3 |
|
Ksp |
4.96×10-9 |
6.82×10-6 |
4.68×10-6 |
5.61×10-12 |
2.64×10-39 |
回答下列问题:
 (1)加入NaOH溶液时发生的离子方程式为
。
(1)加入NaOH溶液时发生的离子方程式为
。
25℃时,向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的
pH=8时,c(Mg2+):c(Fe3+)= 。
(2)“趁热过滤”时的温度应控制在 。
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线所示进行循环使用。请你分析实际工业生产中是否可行 ,并说明理由 。
(4)已知:Na2CO3·10 H2O(s)=Na2CO3(s)+10 H2O(g) △H=+ 532.36kJ·mol-1
Na2CO3·10 H2O(s)=Na2CO3·H2O(s)+9 H2O(g) △H=+ 473.63kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式 。
17.(8分)工业上生产硫酸时,利用催化氧化将SO2转化为SO3是一个关键步骤。
(1)某温度下,SO3(g)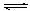 SO2(g)+1/2O2(g);△H= +98 kJ·mol-1。开始时在
SO2(g)+1/2O2(g);△H= +98 kJ·mol-1。开始时在
100L的密闭容器中加入4.0mol SO2(g)和10.0molO2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K= 。
(2)一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:
2SO2(g)+O2(g)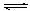 2SO3(g)达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是 。
2SO3(g)达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是 。
A.保持温度和容器体积不变,充入2mol SO3
B.保持温度和容器体积不变,充入2mol N2
C.保持温度和容器体积不变,充入0.5mol SO2和0.25mol O2
 D.保持温度和容器内压强不变,充入1mol SO3
D.保持温度和容器内压强不变,充入1mol SO3
E.升高温度
F.移动活塞压缩气体
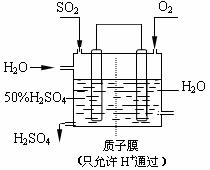
(3)某人设想以右图所示装置用电化学原理
生产硫酸,写出通入SO2的电极的电极
反应式 。
(4)若通入H2O的速率为13.4mL·min-1 ,
为稳定持续生产,硫酸溶液的浓度应维持不变,
则左侧SO2的流入速率(标准状况)应为 L·min-1
16.(10分)以黄铁矿为原料制硫酸产生的废渣中含Fe2O3、SiO2、Al2O3、CaO、MgO等。现以此废渣制备铁红(Fe2O3)的过程如下。此浓度时,部分阳离子以氢氧化物形式沉淀时溶液的pH由见右表。
|
沉淀物 |
开始沉淀pH |
沉淀完全pH |
|
Al(OH)3 |
3.0 |
5.2 |
|
Fe(OH)3 |
1.5 |
2.8 |
|
Fe(OH)2 |
7.6 |
9.7 |
|
Mg(OH)2 |
8.0 |
12.4 |
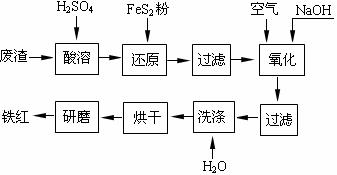
(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式是 。
(2)还原过程中加入FeS2是将溶液中的Fe3+还原为Fe2+,而本身被氧化为SO42-,写出有关的离子方程式: 。
(3)氧化过程中通入空气和加入NaOH是为了将溶液中的铁元素充分转化为沉淀而析出,写出有关的离子方程式: 。
(4)为了确保铁红的质量,氧化过程需要调节溶液pH的范围为 ≤pH< 。
(5)若NaOH加入过量,所的铁红产品中有其它杂质,但可能无Al2O3,其原因是(用离子方程式表示): 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com