
题目列表(包括答案和解析)
5.下列实验不能实现预期目的的是 ( )
A.用食醋、石灰水验证蛋壳的成分是碳酸盐
B.用溴水鉴别甲烷和乙烯
C.用乙醇、乙酸和10%的硫酸溶液共热制乙酸乙酯
D.用酸性高锰酸钾溶液验证苯环上是否存在碳碳双键
4.现有C、CO、CO2、Na2CO3四种物质,采用下列分类标准,无法将其中两种归为一类的是 ( )
A.是否具有还原性 B.是否为氧化物
C.碳元素的化合价是否相同 D.是否为电解质
3.前些年曾有人称制得五种特殊的催化剂,只要将这种催化剂加入水中,水就能变成柴油用于汽车等,这就是“水变油”的闹剧。下列说法中,能够否定“水变油”的是 ( )
A.水的密度比柴油的大  B.水不能燃烧
B.水不能燃烧
C.催化剂可以改变反应速率 D.催化剂不能使本来不存在的反应发生
2.C(石墨)在高温、高压及催化剂存在的条件下能转化为C(金 刚石),该反应为吸热反应,由此可知 (
)
刚石),该反应为吸热反应,由此可知 (
)
A.石墨比金刚石稳定 B.石墨总能量比等质量的金刚石高
C.该变化属于物理变化 D.该反应的焓变△H<0
1.下列做法不能体现节能减排理念的是 ( )
A.推广可利用太阳能、风能的城市照明系统
B.发展核电以减少二氧化硫和二氧化碳排放
C.大量使用一次性木筷
D.使用生物酶降解生活废水中的有机物
19、(12分)(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.2H2(g)+O2(g)=2H2O(1) △H<0
C. NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其正极的电极反应式为 。
(3)电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与下图中电解池相连,其中a为电解液,X和Y均为惰性电极,则:
 ①若a为CuSO4溶液,则电解时的化学反应方程式为
。通过一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为
。
②若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,当阳极产生的气体672 mL(标准状况下)时,溶液的pH = (假设电解后溶液体积不变)。
20、(14分)过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,因而广泛应用于渔业、农业、环保等许多方面。下图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2)的流程。
①若a为CuSO4溶液,则电解时的化学反应方程式为
。通过一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为
。
②若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,当阳极产生的气体672 mL(标准状况下)时,溶液的pH = (假设电解后溶液体积不变)。
20、(14分)过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,因而广泛应用于渔业、农业、环保等许多方面。下图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2)的流程。
 请回答下列问题:
(1)操作①应包括下列操作中的 (填序号)。
A.溶解 B.过滤 C.蒸馏 D.分液 E.蒸发结晶
(2)用氨水调节pH至8-9的目的是 。
(3)若测得滤液C中c(CO32-)=10-3 mol/L,则Ca2+
(填“是”或“否”)沉淀完全。[已知c(Ca2+)≤10-5mol/L可视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
(4)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中,
c(NH4+) c(NO3-)(填“≥”、“≤”、“<”、“>”或“=”)
(5)操作②是:在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,写出该反应的化学方程式
。一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9-11,才出现大量沉淀。用简要的文字解释需用氢氧化钠调节pH至9-11的原因 。
(6)已知大理石含CaCO3的质量分数为a,mg大理石可以制得ngCaO2,请计算:CaCO3转化为CaO2过程中,Ca原子的利用率为 。
请回答下列问题:
(1)操作①应包括下列操作中的 (填序号)。
A.溶解 B.过滤 C.蒸馏 D.分液 E.蒸发结晶
(2)用氨水调节pH至8-9的目的是 。
(3)若测得滤液C中c(CO32-)=10-3 mol/L,则Ca2+
(填“是”或“否”)沉淀完全。[已知c(Ca2+)≤10-5mol/L可视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
(4)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中,
c(NH4+) c(NO3-)(填“≥”、“≤”、“<”、“>”或“=”)
(5)操作②是:在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,写出该反应的化学方程式
。一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9-11,才出现大量沉淀。用简要的文字解释需用氢氧化钠调节pH至9-11的原因 。
(6)已知大理石含CaCO3的质量分数为a,mg大理石可以制得ngCaO2,请计算:CaCO3转化为CaO2过程中,Ca原子的利用率为 。
2010-2011学年泉州一中期末考试
18、(18分)下图是无机物A-M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属,K是一种红棕色气体。M的溶液显浅绿色。
 请填写下来空白:
(1)M的化学式
,I的原子结构示意图
,在周期表中,在周期表中,组成单质G的元素位于第 周期第 族。
(2)M中阳离子如何检验
(3)在反应②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应的是
(填写序号)
(4)反应④的离子方程式是:
(5)将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O。写出该反应的化学方程式并标明电子转移数目和方向:
请填写下来空白:
(1)M的化学式
,I的原子结构示意图
,在周期表中,在周期表中,组成单质G的元素位于第 周期第 族。
(2)M中阳离子如何检验
(3)在反应②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应的是
(填写序号)
(4)反应④的离子方程式是:
(5)将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O。写出该反应的化学方程式并标明电子转移数目和方向:
(4)每生成1 mol气态B,反应放出98.3kJ热量,该反应的热化学方程式为 。
17、(10分)已知N2O4(无色)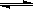 2NO2
(红棕色) ,在80℃时,将0.80mol的N2O4气体充入4 L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2
(红棕色) ,在80℃时,将0.80mol的N2O4气体充入4 L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
|
时间(S) |
0 |
20 |
40 |
60 |
80 |
100 |
|
n( N2O4 )(mol) |
0.80 |
a |
0.40 |
c |
d |
e |
|
n(NO2)(mol) |
0.00 |
0.48 |
b |
1.04 |
1.20 |
1.20 |
(1)计算20s-40s内用NO2表示的平均反应速率为 mol·L-1·s-1,
平衡时N2O4的转化率为
(2)计算在80℃时该反应的平衡常数K= ; (3)要增大该反应的K值,可采取的措施有(填序号) A.向混合气体中通入NO2 B.使用高效催化剂 C.升高温度 D.增大N2O4的起始浓度
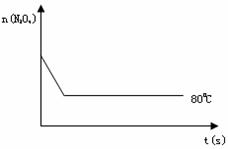
(4)反应达到平衡后,将温度升高至100℃,发现颜色加深,则△H 0
(5)如右图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在100℃时N2O4物质的量的变化曲线(反应物起始的物质的量相等)。
16、从下列事实所列出的相应结论正确的是
|
|
实
验 事 实 |
结
论 |
|
① |
Cl2的水溶液可以导电 |
Cl2是电解质 |
|
② |
将燃烧的镁条放入CO2中能继续燃烧 |
还原性:Mg>C |
|
③ |
NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 |
酸性:HCO3->Al(OH)3 |
|
④ |
常温下白磷可自燃而氮气须在放电时才与氧气反应 |
非金属性:P>N |
|
⑤ |
某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 |
该溶液一定有NH4+ |
A.①②③ B.②③⑤ C.③④⑤ D.全部
15、25℃时,有关弱酸的电离平衡常数如下:
|
弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
|
电离平衡常数(25℃) |
1.8×10-5 |
4.9×10-10 |
K1=4.3×10-7
K2=5.6×10-11 |
下列有关说法正确的是 A.等物质的量浓度的各溶液pH关系为:CH3COONa>Na2CO3>NaCN B.a mol/L NaOH溶液与b mol/LHCN溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b C.在冰醋酸中逐滴加水,则溶液的导电性和醋酸的电离程度均先增大后减小 D.NaHCO3和Na2CO3混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HCO3-)+ 2c(CO32-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com