
题目列表(包括答案和解析)
5.若ⅣA表示阿伏加德罗常数的值,下列说法正确的是 。
A.含有ⅣA个氖原子的氖气在标准状况下的体积约为ll.2L
B.2.39Na被O2完全氧化时,失去0.1 NA个电子
C.2Llmol·L-1的醋酸溶液中含有2NA个醋酸分子
D.标准状况下,5.6L苯含有O.25NA个分子
4.钢铁在潮湿的空气中会形成原电池而被腐蚀,下列说法正确的是
A.钢铁设备上连接铜块可以防止腐蚀
B.原电池的正极反应为:o2+2H20+4e一叫0H-
C.原电池的负极反应为:Fe---,Fe3++3e-
D.钢铁与外加直流电源的正极相连可以防止腐蚀 ’ .
3.短周期元素X、Y、Z在元素周期表中的位置如下图所示,下列说法正确的是
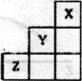
A.X、Y、z三种元素中,Y的非金属性最强
B.Y的气态氢化物的稳定性比Z的弱
C.Y的原子半径在同周期元素中最大
D.X单质的熔点比2单质的熔点高
2.下列分类正确的是
A.同位素:1H、D+、T2
B.电解质:H20、CH3COOH、NH4HC03
C.胶体:饱和氯化铁溶液、淀粉溶液、牛奶
D.硅酸盐产品:水晶、水泥、陶瓷
1.下列叙述正确的是
A.“雨后彩虹”是一种自然现象,;与胶体的知识有关
B.“农夫山泉”纯净水不含任何化学成分
C.“通风橱”是一种负责任的防污染手段,可使有害气体得到转化或吸收
D.长期盛放NaOH溶液的滴瓶不易打开,是因为NaOH与瓶中的C02反应使瓶内气体减少形成“负压”之故
20.(10分) 常温下将一块钠露置在空气中一段时间后,甲、乙两位同学把固体分成两份,各取一份同时进行实验,欲探究其组成和含量。请根据要求回答下列问题。
甲 同学:将一份放入烧瓶中,加入稀硫酸后,生成无色无味的气体,据分析推理可能有二氧化碳和氢气,然后进行气体成份的验证实验。
同学:将一份放入烧瓶中,加入稀硫酸后,生成无色无味的气体,据分析推理可能有二氧化碳和氢气,然后进行气体成份的验证实验。
( 1)为验证气体产物中是否含有二氧化碳和氢气,需从下图中选择必要的仪器和药品,设计一套装置验证气体成份。装置的连接顺序为:d→
→
→
→
1)为验证气体产物中是否含有二氧化碳和氢气,需从下图中选择必要的仪器和药品,设计一套装置验证气体成份。装置的连接顺序为:d→
→
→
→
→ → 。(填下列装置的接口字母)
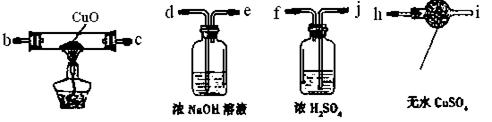
(2)实验过程中观察到石灰水变浑浊,由此可判断原固体中含有的物质是________(填化学式)。
乙同学将另一份进行以下实验。


(3)用浓盐酸配制500mL 3.00mol·L-1的稀盐酸时,需要使用的玻璃仪器除了量筒、烧杯、胶头滴管、玻璃棒以外,还有 。
(4)在操作II中,发生反应的离子方程式为 。
(5)操作IV中用盐酸标准 液滴定滤液时,滴定终点的现象是
。
液滴定滤液时,滴定终点的现象是
。
(6)若操作IV中,消耗3.00mol·L-1的盐酸标准液50.00 mL,通过计算判断,5.00g固体中是否含有NaOH________(填有或无),质量是________g(若你认为无NaOH,则此空不用答)。
龙岩市2010-2011学年度高三第一次教学质量检查
19.(12分) 硫酸工业中废渣称为硫酸渣,其成分为SiO2、Fe2O3、Al2O3、MgO。某探究性学习小组的同学设计以下方案,进行硫酸渣中金属元素的提取实验。

已知溶液pH=3.7时,Fe3+已经沉淀完全;一水合氨电离常数Kb=1.8×10-5,其饱和溶液中c(OH-)约为1×10-3mol·L-1。请回答:
(1)写出A与氢氧化钠溶液反应的化学方程式: 。
(2)上述流程中两次使用试剂①,推测试剂①应该是 (填以下字母编号)
A.氢氧化钠 B.氧化铝 C.氨水  D.水
D.水
(3)溶液D到固体E过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是 ;(任写一点)
(4)H中溶质的化学式: ;
(5)计算溶液F中c(Mg2+)= ( 25℃时,氢氧化镁的Ksp=5.6×10-12)
18.(12分)室温下,水溶液体系中的化学反应I- + OCl- = OI- + Cl-的反应物初始浓度、溶液中的OH-初始浓度及初始速率间的关系如下表所示:
|
实验 编号 |
I-的初始浓度 (mol·L-1) |
OCl-的初始浓度 (mol·L-1) |
OH-的初始浓度 (mol·L-1) |
初始速率v (mol·L-1· s-1) |
|
1 |
2 × 10–3 |
1.5 × 10–3 |
1.00 |
1.8 × 10–4 |
|
2 |
a |
1.5 × 10–3 |
1.00 |
3.6 × 10–4 |
|
3 |
2 × 10–3 |
3 × 10–3 |
2.00 |
1.8 × 10–4 |
|
4 |
4 × 10–3 |
3 × 10–3 |
1.00 |
7.2  × 10–4 × 10–4 |
已 知表中初始反应速率与有关离子浓度关系可以表示为v= k [I-]1 [OCl-]b [OH-]c(温度一定时,k为常数)。
知表中初始反应速率与有关离子浓度关系可以表示为v= k [I-]1 [OCl-]b [OH-]c(温度一定时,k为常数)。
(1)为开展实验1,某同学取5mL0.02mol·L-1碘化钾溶液、5mL0.015 mol·L-1次氯酸钠溶液、40mL某浓度氢氧化钠溶液混合反应。则该氢氧化钠溶液物质的量浓度为 ;
(2)实验2中,a= ;
(3)设计实验2和实验4的目的是 ;
(4)计算b、c值:b=
;c =
;
=
;
(5)若实验编号4的其它浓度不变,仅将溶液的酸碱值变更为pH = 13,反应的初始速率v= 。
17.(12分)部分短周期元素的原子半径及常见化合价如下表:
|
元素代号 |
Z |
M |
Q |
R |
T |
X |
|
原子半径/nm |
0.077 |
0.130 |
0.111 |
0.099 |
0.073 |
0.102 |
|
常见化合价 |
+4 ,-4 |
+2 |
+4 ,-4 |
-1,+7 |
-2 |
+6,-2 |
根据要求回答问题(如需填化学用语的,请用各元素的元素符号表示)
(1) X元素在元素周期表的位置是 。
(2) R的气态氢化物比X的气态氢化物
 (填稳定或不稳定)。
(填稳定或不稳定)。
(3)写出M的单质与ZT2反应的化学方程式 。
(4)Q的最高价氧化物在现代通信的重要用途是 。
(5)己知XO2在500℃,1大气压下被氧气氧化,每生成1 mol气态XO3,放出98.3 kJ热量,该反应的热化学方程式是
(6)工业上用Z的单质与水蒸汽反应制水煤气,则该反应的平衡常数表达式K= 。
16. (9分)近期市场上出现一种无需火电,无需热水的自热米饭。自热米饭饭盒中有发热包,发热包中有一小包粉末及少量液体(水)。根据要求回答问题:
(1)对发热包中粉末的成分,甲在查阅资料的基础上,认为可能含有镁粉、铁粉、碳粉、氯化钠固体等物质,并通过下述实验来检验:
①将磁铁放置于粉末中,部分固体被吸引,说明粉末中含 ;
②取①未被磁铁吸引的粉末用水溶解,过滤。往滤液中滴入硝酸银溶液,有白色沉淀,说明粉末含有 ;
③取步骤②的不溶物,滴加稀硫酸直至过量,过滤,得到黑色固体,说明发热包中含有
;
④取步骤③滤液并加入足量氢氧化钠溶液,出现白色沉淀,说明发热包中有 。
(2)甲注意到说明书上的提示:使用时,操作控件使发热包中的粉末与液体混合而放热。放热过程分两个阶段:第一阶段,较短的时间内产生大量的热,使饭煮熟;第二阶段,持续温和地放热,达到保温的目的。据此,他认为饭盒工作时应有两个原电池反应发生。
快速发热时负极反应式为 ,
保温时正极电极反应式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com