
题目列表(包括答案和解析)
2.下列化学用语错误的是
A.NaCl的电子式  B.甲烷的结构式
B.甲烷的结构式 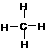

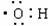
C.氨分子的结构式 D.羟基电子式
在每个小题给出的四个备选答案中,只有一个符合题目的要求。
1.化学与科学、技术、社会、环境密切相关,下列做法中不正确的是yjw
A.回收废旧电池,主要目的是回收其中的金属
B.减少燃煤使用,改用风能、太阳能等能源,符合“低碳生活”的理念
C.在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质
D.用浸泡过高锰酸钾溶液的硅藻土吸收水果中的乙烯,可以实现水果保鲜的目的
31.某校实验员将一定量的KClO3与若干MnO2混合,由于MnO2含量过少, KClO3与MnO2不能充分接触,加热后① KClO3分解生成KCl和O2 ;②4KClO3
KClO3与MnO2不能充分接触,加热后① KClO3分解生成KCl和O2 ;②4KClO3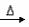 3KClO4+KCl 。上述两个反应同时发生。
3KClO4+KCl 。上述两个反应同时发生。
(1)若取用的KClO3为98.0克,放置在试管中加热至质量不再变化时,得到的KClO4的质量为27.7克,则收集到标准状况下的O2多少升?
(2)若使98.0克KClO3在一定条件下完全分解可生成KCl的物质的量为多少?
(3)若取用的KClO3为73.5克,放置在试管中加热,当生成0.25摩尔KCl和6.72升标准状况的O2时停止加热,则该反应中KClO3的分解率为多少?
(4)若取用的KClO3为122.5克,在一定条件下完全反应分解生成x摩尔KCl和y摩尔O2,试建立y和x之间的函数关系。
30.今有一包铁粉和铜粉混合粉末,为确定其组成,现提供4mol/L的FeCl3溶液(其他用品略),某合作学习小组同学的实验结果如下(假定反应前后溶液体积不变):
|
组别 |
① |
② |
③ |
④ |
|
V[FeCl3(aq)]/mL |
100 |
100 |
100 |
100 |
|
混合粉末质量/g |
6 |
13.2 |
24 |
36 |
|
反应后剩余固体质量/g |
0 |
1.28 |
12.8 |
24.8 |
(1) 试判断第②组剩余固体的成分为
 ;
;
(2)原混合粉末中Fe、Cu的物质的量之比为 ;
(3)第①组所得溶液的Fe2+的物质的量浓度为 。
29.已知:①苯和卤代烃在催化剂作用下可以生成烷基苯和卤化氢,例如:
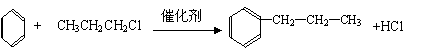
 ②苯的同系物(如甲苯、乙苯等)能被酸性高锰酸钾氧化为苯甲酸,例如:
②苯的同系物(如甲苯、乙苯等)能被酸性高锰酸钾氧化为苯甲酸,例如:
根据以下转化关系(生成物中所有无机物均已略去),回答下列问题:
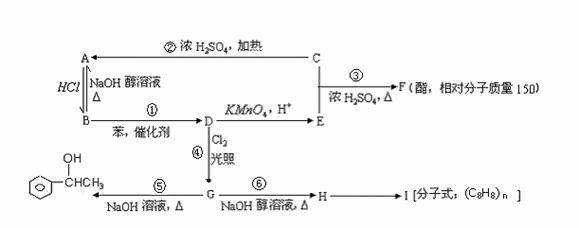
(1)在①-⑥六个反应中,属于取代反应的是(填反应编号) 。
(2)写出物质的结构简式F ,I 。
(3)能与FeCl3溶液反应呈紫色的E的同分异构体有 种。
(4)写出下列化学方程式:
B →D:

 ;
;
G →H: 。
28.有机物A(C13H18O2)具有香味,可有作香皂、洗发香波的芳香剂
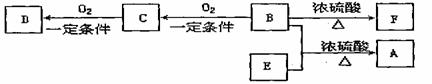
已知:① B属于芳香族化合物,分子式为C8H10O; ② D、E具有相同官能团,E分子烃基上只有一种氢原子;③ F可以使溴的四氯化碳溶液褪色。
回答下列问题:
(1)B不能发生的反应有 (填数字序号)。
①取代反应 ②消去反应 ③加聚反应 ④缩聚反应
(2)C分子中的含氧官能团的名称是 。
(3)D的同分异构体有多种,写出同时符合下列条件的所有物质的结构简式
a.属于芳香族化合物且苯环上的一氯代物有两种;
b.含
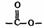 基团。
基团。
(4)B和E反应生成A的化学方程式为 。
27.某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹)。
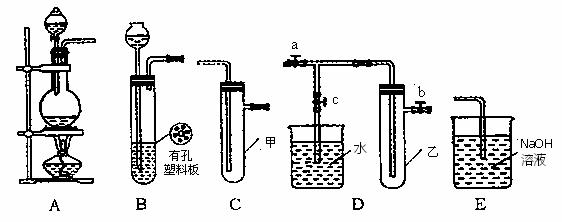
(1)请利用上述装置设计一个简单的实验验证Cl-和Br-的还原性强弱。
①选择合理的装置连接: → → 。(填字母编号)
②从下列提供的试剂选择你所需的试剂: 。(填字母编号)
a. 固体氯化钠 b. 固体二氧化锰 c. 浓硫酸
d. 浓盐酸 e. 稀盐酸 f. 溴化钠溶液
③实验现象及结论: 。
(2)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验,其操作步骤为
①先关闭止水夹 ,再打开止水夹 ,使NO2充满试管乙。接着关闭止水夹
,打开止水夹  ,最后微热试管乙,使烧杯中的水倒流进入试管乙。
,最后微热试管乙,使烧杯中的水倒流进入试管乙。
②试管乙中的NO2与 水充分反应后,若向试管内缓缓通入一定量的O2,直至试管 全部充满水,则所得溶液中溶质的物质的量浓度是 (气体按标准状况计算)。
水充分反应后,若向试管内缓缓通入一定量的O2,直至试管 全部充满水,则所得溶液中溶质的物质的量浓度是 (气体按标准状况计算)。
26.某同学设计了以下流程来检验碳酸钠粉末中含有少量氯化钠和氢氧化钠。

(1)步骤3的操作名称是 ;步骤1所需玻璃仪器是 ;
(2)试剂A是 ,加入试剂A 的目的是 ;(填字母编号)
a. 检验OH- 离子 b. 检验Cl-离子
c. 除去CO32-离子 d. 避免对Cl-或OH-的检验的干扰
判断试剂A是否足量的方法是 。
(3)步骤4是为了检验 离子,所需要的试剂B是 。
(4)请简述步骤5的具体操作过程(所加试剂、现象及结论)
。
25.T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量变化如图1所示,3分钟时达到平衡;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。
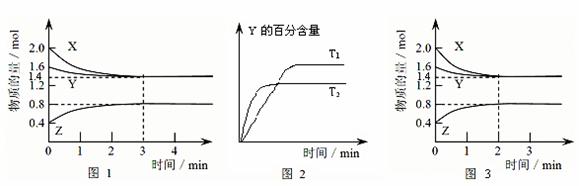
(1)容器中发生的反应可表示为______ ________ ________ __
(2)反应进行的前3 min内,用X表示的反应速率 v(X)=____________
(3)保持其他条件不变,升高温度,该反应的化学平衡常数K将____________(填“变大”、“减小”或“不变”)
(4)①若改变反应条件,使反应进程如图3所示,则改变的条件是____________
②一定条件下的密闭容器中,该反应达到平衡,要提高气体Y的转化率,可以采取的措施是__________(填字母代号)。
a.高温高压 b.加入催化剂 c.减少Z的浓度 d.增加气体Y的浓度
24.氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为
a HClO3 → bO2↑+ c Cl2↑+ d HClO4 + e H2O,
(1)该反应的氧化产物是___ __
(2)若化学计量数a=8,b=3,则c=___;d= ___;你判断的依据是_ _。
(3)若氯酸分解所得混合气体,经干燥后,lmol混合气体质量为51.5g,请配平该反应方程式:
___HClO3 →___O2↑+ ___Cl2↑+ ___ HClO4 + ___ H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com