
题目列表(包括答案和解析)
5、下列叙述错误的是………………………………………………………………( )
A、金属被腐蚀,就是金属原子失去电子被氧化的过程
B、与金属反应时,稀HNO3可能被还原为更低价态,则稀HNO3氧化性强于浓HNO3
C、一水合氨易分解,在实验室里浓氨水密封保存在无色试剂瓶中,并放在阴凉通风处
D、硫在纯净氧气中燃烧,产生明亮的蓝紫色火焰
4、下列叙述中,正确的是……………………………………………………………( )
A、H2SO4的摩尔质量是98
B、标准状况下,11.2L甲烷气体所含氢原子个数为2NA
C、等质量的氧气和臭氧中所含的氧原子数不相等
D、将40gNaOH溶解于500mL水中,所得溶液中NaOH的物质的量浓度为2 mol/L
3、下列具有特殊性能的材料中,由主族元素和副族元素形成的是………………( )
A、半导体材料砷化镓 B、吸氢材料镧镍合金
C、透明陶瓷材料硒化锌 D、超导材料K3C60
2、化学科学需借助化学专用语言来描述,下列有关化学用语正确的是……………( )
A、硫离子的核外电子排布式 1s22s22p63s23p6
B、氢气燃烧的热化学方程式:H2(气) + 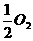 (气) →
H2O + 285千焦
(气) →
H2O + 285千焦
C、明矾的化学式:KAlSO4•12H2O
D、次氯酸的结构式为:H-Cl-Oyjw
1、下列叙述合理的是…………………………………………………………………………( )
A、凡是有食品添加剂的食物对人体健康均有害,不可使用
B、汽油、柴油和植物油都是碳氢化合物
C、水电站是把机械能转化为电能,核电站是把化学能转化为电能
D、“水滴石穿”原因之一是溶解了CO2的雨水与CaCO3长期作用,生成了可溶的Ca(HCO3)2yjw
27.(14分)
Ⅰ.已知:R-CH=CH-O-R′(烃基烯基醚) R-CH2CHO + R′OH
R-CH2CHO + R′OH
烃基烯基醚A的相对分子质量(M r)为176,分子中碳氢原子数目比为3∶4 。与A相关的反应如下:
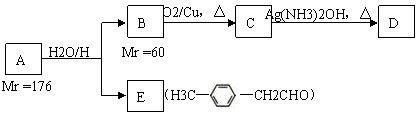

请回答下列问题:
⑴ A的分子式为 ;
⑵ B的名称是 ;A的结构简式为 ;
⑶ 写出C → D反应的化学方程式: ;
⑷ 写出两种同时符合下列条件:① 属于芳香醛;② 苯环上有两种不同环境的氢原子E的同分异构体的结构简式: 、 。
⑸ 写出由E转化为对甲基苯乙炔(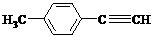 )的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
)的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
⑹ 请写出你所写出的流程图中最后一步反应的化学方程式 。
石景山区2010-2011学年第一学期期末考试试卷
26.(6分)在下列化合物中
H2C=O HOCH2CH2OH 

 CH2=CH2
CH2=CH2
⑴适于制作塑料食品盒的单体是 ,聚合反应方程式为 ;
⑵适于配制不锈钢锅柄的单体是_________,聚合物的结构简式为____________;
⑶可制造合成纤维织物的单体是_________,它的聚合反应的方程式是________。
25.(7分)
⑴ 事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是____________________________。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.2H2(g)+O2(g)=2H2O(1) △H<0
C.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
⑵ 以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其正极的电极反应式为__________________________________。
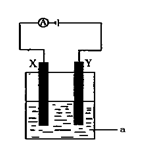 ⑶ 电解原理在化学工业中有着广泛的应用。现将你设计的
⑶ 电解原理在化学工业中有着广泛的应用。现将你设计的
原电池通过导线与右图中电解池相连,其中a为电解液,
X和Y均为惰性电极,则:
①若a为CuSO4溶液,则电解时的化学反应方程式为
____________________________________。
②若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,当阳极产生的气体672 mL(标准状况下)时,溶液的pH = (假设电解后溶液体积不变)。
24.(8分)
I.如图1为向25mL 0.1mol·L-1NaOH溶液中逐滴滴加0.2mol·L-1CH3COOH溶液过程中溶液pH的变化曲线。请回答:
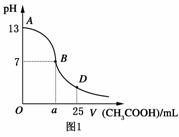
⑴ B点溶液呈中性,有人据此认为,在B点时NaOH与CH3COOH恰好完全反应,这种看法是否正确?________(选填“是”或“否”)。若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内?________区间(若正确,此问不答)。
 ⑵ 关于该滴定实验,从下列选项中选出最恰当的一项________(选填字母)。
⑵ 关于该滴定实验,从下列选项中选出最恰当的一项________(选填字母)。
|
|
锥形瓶中溶液 |
滴定管中溶液 |
选用指示剂 |
选用滴定管 |
|
A |
碱 |
酸 |
酚酞 |
(乙) |
|
B |
酸 |
碱 |
甲基橙 |
(甲) |
|
C |
碱 |
酸 |
石蕊 |
(甲) |
|
D |
酸 |
碱 |
酚酞 |
(乙) |
⑶ AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是________。
A.c(OH-)大于c(CH3COO-) B.c(OH-)小于c(CH3COO-)
C.c(OH-)等于c(CH3COO-) D.上述三种情况都可以
⑷ 在D点时,溶液中c(CH3COO-)+c(CH3COOH)________2c(Na+)(填“>”“<”或“=”)。
Ⅱ.t℃时,某稀硫酸溶液中c(H+) = 10-a mol·L-1,c(OH-) = 10-b mol·L-1,已知
a+b=13:
⑸ 该温度下水的离子积常数Kw的数值为________。
⑹ 该温度下(t℃),将100mL 0.1mol·L-1的稀H2SO4与100mL 0.4mol·L-1的NaOH溶液混合(溶液体积变化忽略不计),溶液的pH=________。
23.(9分)已知2X2(g)+Y2(g)

 2Z(g) ΔH=-akJ·mol-1(a>0),在一个容积固定的容器中加入2mol X2和1mol Y2 , 在500℃时充分反应达平衡后Z的浓度为W mol·L-1,放出热量b kJ。
2Z(g) ΔH=-akJ·mol-1(a>0),在一个容积固定的容器中加入2mol X2和1mol Y2 , 在500℃时充分反应达平衡后Z的浓度为W mol·L-1,放出热量b kJ。
⑴ 此反应平衡常数表达式为_________________;若将温度降低到300℃,则反应平衡常数将___________(填增大、减少或不变)。
⑵ 若原来容器中只加入2mol Z,500℃充分反应达平衡后,吸收热量c kJ,则Z浓度_______Wmol·L-1(填“>”、“<”或“=”),a、b、c之间满足关系___________(用代数式表示)。
⑶ 能说明反应已达平衡状态的是___________________。
A. 浓度c(Z)=2c(Y2) B. 容器内压强保持不变
C. v逆(X2)=2v正(Y2) D. 容器内的密度保持不变
⑷ 若将上述容器改为恒压容器(反应器开始体积相同),相同温度下起始加入2mol X2和1mol Y2达到平衡后,Y2的转化率将_____(填“变大”、“变小”或“不变”) 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com