
题目列表(包括答案和解析)
26、我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。
他利用NaHCO3、NaCl、NH4Cl等物质溶解度的差异,以食盐、氨气、二氧化碳等为原料制得NaHCO3,进而生产出纯碱。以下A、B、C、D四个装置可组装成实验室模拟“侯氏制碱法”制取NaHCO3的实验装置。装置中分别盛有以下试剂:B:稀硫酸C:盐酸、碳酸钙D:含氨的饱和食盐水、水
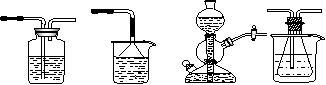
A B C D
四种盐在不同温度下的溶解度(g/100g水)表

|
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
60℃ |
100℃ |
||||
|
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
39.8 |
||||
|
NH4HCO3 |
11.9 |
15.8 |
21.0 |
27.0 |
-① |
- |
- |
- |
||||
|
NaHCO3 |
6.9 |
8.1 |
9.6 |
11.1 |
12.7 |
14.5 |
16.4 |
- |
||||
|
NH4Cl |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
55.3 |
77.3 |
(说明:①>35℃NH4HCO3会有分解)
请回答以下问题:
⑴装置的连接顺序应是_______________(填字母);
⑵A装置中盛放的试剂是_______________,其作用是_____________________;
⑶在实验过程中,需要控制D温度在30℃-35℃,原因是____________________________
,
为了便于控制此温度范围,采取的加热方法为___________;
⑷将锥形瓶中的产物过滤后,所得的母液中含有_____________________(以化学式表示),可加入氯化钠,并进行_______操作,使NaCl溶液循环使用,同时可回收NH4Cl。
⑸测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品Wg,放入锥形瓶中加蒸馏水溶解,加1-2滴酚酞指示剂,用物质的量浓度为c(mol/L)的HCl溶液滴定至溶液由红色到无色(指示CO32―+H+→HCO3―反应的终点),所用HCl溶液体积为V1 mL,再加1-2滴甲基橙指示剂,继续用HCl溶液滴定溶液由黄变橙,所用HCl溶液体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3(%)=_____________________。
25、二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:
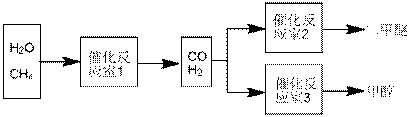
请填空:
(1)在一定条件下,反应室1中发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)+Q, Q<0。
CO(g)+3H2(g)+Q, Q<0。
 在其它条件不变的情况下降低温度,逆反应速率将_______
(填“增大”、“减小”或“不变”)。将1.0molCH4和2.0molH2O通人反应室1(假设容积为100L),10min末有0.1molCO生成,则10min内反应的平均速率V(H2)=________。
在其它条件不变的情况下降低温度,逆反应速率将_______
(填“增大”、“减小”或“不变”)。将1.0molCH4和2.0molH2O通人反应室1(假设容积为100L),10min末有0.1molCO生成,则10min内反应的平均速率V(H2)=________。
(2)在一定条件下,已知反应室2的可逆反应除生
成二甲醚外还生成了气态水,其化学方程式为
_________________________________________。
(3)在压强为0.1MPa条件下,反应室3(容积为VL)中
amolCO与2amolH2在催化剂作用下反应生成甲醇:CO(g)
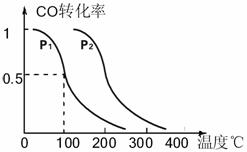
+2H2(g)  CH3OH(g),CO的平衡转化率与温度、压强的关系如右图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如右图所示,则:
① P1 P2 (填“<”、“>”或“=”),正反应为_____(“放热”或“吸热”)反应。
②在其它条件不变的情况下,反应室3再增加amolCO与2amolH2,达到新平衡时,CO的转化率______(填“增大”、“减小”或“不变”。下同。),平衡常数________。
③在P1压强下,100℃时,CH3OH(g)  CO(g) + 2H2(g)反应的平衡常数为 (用含a、V的代数式表示)。
CO(g) + 2H2(g)反应的平衡常数为 (用含a、V的代数式表示)。
24、三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有: HF、 NO 和 HNO3 ,请根据要求回答下列问题:
(1)反应过程中,被氧化与被还原的元素的物质的量之比为_______________。
(2)写出该反应的化学方程式,并标出电子转移的方向和数目:
______________________________________________________________________。
若反应中生成0.2 mol HNO3,转移的电子数目为______________________个。
(3)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现。你判断该气体泄漏时的现象是______________________________________________________。
(4)一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF、H2O外。还肯定有______________(填化学式)。
23、 Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
 ①Z的原子序数为26,其余的均为短周期主族元素;
①Z的原子序数为26,其余的均为短周期主族元素;
 ②Y原子价电子(外围电子)排布msnmpn
②Y原子价电子(外围电子)排布msnmpn
 ③R原子核外L层电子数为奇数;
③R原子核外L层电子数为奇数;
 ④Q、X原子p轨道的电子数分别为2和4。
④Q、X原子p轨道的电子数分别为2和4。
 请回答下列问题:
请回答下列问题:

 (1)Z3+ 的核外电子排布式是
,
(1)Z3+ 的核外电子排布式是
,
 (2)写出Z(OH)2在潮湿的空气中氧化为Z(OH)3的化学方程式
,
(2)写出Z(OH)2在潮湿的空气中氧化为Z(OH)3的化学方程式
,
 (3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是 ,
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是 ,
 a、稳定性:甲>乙,沸点:甲>乙 b、稳定性:甲>乙,沸点:甲<乙
a、稳定性:甲>乙,沸点:甲>乙 b、稳定性:甲>乙,沸点:甲<乙
 c、稳定性:甲<乙,沸点:甲<乙 d、稳定性:甲<乙,沸点:甲>乙
c、稳定性:甲<乙,沸点:甲<乙 d、稳定性:甲<乙,沸点:甲>乙
 (4)Q、R、Y三种元素的原子半径从大到小的顺序为
(用元素符号作答)
(4)Q、R、Y三种元素的原子半径从大到小的顺序为
(用元素符号作答)
 (5)Q的一种氢化物相对分子质量为26,其电子式为
,
(5)Q的一种氢化物相对分子质量为26,其电子式为
,
 (6)X和Y形成的化合物晶体属于
。
(6)X和Y形成的化合物晶体属于
。
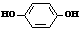
21、下列有关实验处理方法正确的是……………………………………………( )
A、实验室常采用浓硫酸使甲酸脱水的方法制备一氧化碳气体
B、实验室制备乙酸乙酯时,为了提纯乙酸乙酯常用水和氢氧化钠溶液洗涤
C、在苯酚钠的水溶液中通入过量的二氧化碳气体后进行过滤获得苯酚
D、有少量硫酸亚铁溶液的试管中逐滴加入氢氧化钠溶液,边滴加边振荡制备氢氧化亚铁
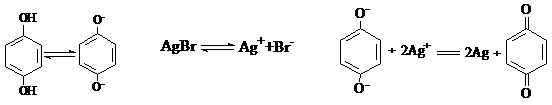
|
A、在显影过程中 是氧化剂
B、溶于显影液的O2能加快显影速度
C、在显影液中加入一定量Na2CO3,可加快显影速度
D、曝光时产生的微量Ag在显影时起了催化作用
第Ⅱ卷(共84分)
20、下列离子方程式书写正确的是…………………………………………( )
A、碳酸氢钙与过量石灰水 Ca2++HCO3-+OH-→CaCO3↓+H2O
B、次氯酸钙中通入少量 SO2气体 Ca2++2ClO-+SO2+H2O→CaSO3↓+2HClO
C、碳酸氢铵溶液与足量 NaOH反应 NH4++ HCO3-+2OH-→NH3↑+H2O+ CO32-
D、明矾中加入过量氨水 Al3++3NH3·H2O→Al(OH)3↓+3NH4+
19、某二元酸(化学式用H2A表示)在水中的电离方程式是: H2A → H++HA-,
HA- H++A2-;则在0.1mol.L-1的Na2A溶液中,下列微粒浓度关系式不合理的是…( )
H++A2-;则在0.1mol.L-1的Na2A溶液中,下列微粒浓度关系式不合理的是…( )
A、c(A2-) +c( HA-)+c( H2A) =0.1mol·L-1 B、c(OH-)=c(H+) +c( HA-)
C、c(Na+ )+ c(H+) =c(OH-)+ c( HA-)+2c(A2-) D、c(Na+ )= 2c(A2-) +2c( HA-) +c( H2A)
18、一定能在下列溶液中大量共存的离子组是………………………………( )
A、水电离产生的c(H+)=1×10-12mol/L溶液:NH4+、Na+、Cl-、I-
B、能使pH试纸变深蓝色的溶液中:Na+、AlO2-、S2-、CO32-
C、含有大量Fe3+的溶液:HCO3-、Cu2+、K+、Br-
D、澄清透明的无色溶液中:ClO-、SCN-、Al3+、SO42-
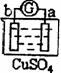
17、有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
|
实验装置 |
部分实验现象 |
|
|
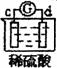
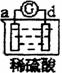
由此可判断这四种金属的活动性顺序是……………………………………………………( )
A、a>b>c>d B、b>c>d>a C、d>a>b>c D、a>b>d>c
16、某学生设计了下述实验室分馏石油的实验,分为五个步骤。
①将蒸馏烧瓶放在铁架台上,在蒸馏烧瓶上塞好带温度计的橡胶塞。
②连接好冷凝管,把冷凝管固定在铁架台上,将冷凝管的一端和水龙头连接,将出水口一端的橡胶管放入水槽中。
③把酒精灯放在铁架台上,根据酒精灯高度调整铁圈的高度,放好石棉网。
④向蒸馏烧瓶中放入碎瓷片,再用漏斗向烧瓶中加入原油,塞好带温度计的塞子,将牛角管接在冷凝管的末端,并深入锥形瓶中。
⑤检查气密性(利用给固定装置微热的方法)。
正确的操作顺序是………………………………………………………………( )
A、②①③⑤④ B、③①②⑤④
C、①②③④⑤ D、⑤④③②①
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com