
题目列表(包括答案和解析)
26. 某课外化学兴趣小组在实验室制备氨气,并进行有关氨气的性质探究。 (1)该小组同学加热生石灰与氯化铵的混合物制取干燥的氨气。 ①应该选用的仪器及装置有(填字母) 。
 ②生石灰与氯化铵反应生成氨气的化学方程式为
。
(2)该小组同学设计如右下图2所示装置探究氨气的还原性。
①氨催化氧化的化学方程式为
。该反应所用的催化剂一般
②生石灰与氯化铵反应生成氨气的化学方程式为
。
(2)该小组同学设计如右下图2所示装置探究氨气的还原性。
①氨催化氧化的化学方程式为
。该反应所用的催化剂一般
选用 (填写化合物名称) 。 ②若实验时通入氨气的速率过快,在烧瓶中会出现白烟,该物质的化学式可能为 。 (3)该小组同学以氨气和二氧化碳为原料拟制备碳酸氢铵。 ①甲同学先将二氧化碳通入水中,充分溶解后,再通入氨气;乙同学先将氨气通入水中,充分溶解后,再通入二氧化碳。选择合适的方案并说明原因。 同学方案比较合理,因为 。 ②检验产物中有NH4+的方法为 。
25. 硫酸是重要的化工原料,二氧化硫生成三氧化硫是工业制硫酸的重要反应之一。
(1)现将一定量的SO2(g)和O2(g)放入某固定体积的密闭容器中,在一定条件下,反应2SO2(g)+O2(g)  2SO3(g)达到平衡状态。
①从平衡角度分析采用过量O2的目的是
;判断该反应达到平衡状态的标志是_____________。(填字母)
2SO3(g)达到平衡状态。
①从平衡角度分析采用过量O2的目的是
;判断该反应达到平衡状态的标志是_____________。(填字母)
a.SO2和SO3 浓度相等 b.SO2百分含量保持不变
 c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
②该反应的平衡常数表达式为:K=___________。
③已知:K(300℃)>K(450℃),该反应是________热反应。若反应温度升高,SO2的转化率 (填“增大”、“减小”或“不变”)。
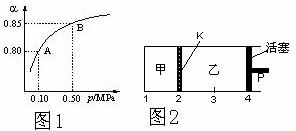
 (2)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图1所示。平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”,下同)。
(3)如图2所示,保持温度不变,将2 mol SO2和1 mol O2加入甲容器中,将4 mol SO3加入乙容器中,隔板K不能移动。此时控制活塞P,使乙的容积为甲的2倍。
①若移动活塞P,使乙的容积和甲相等,达到新平衡时,SO3的体积分数甲
乙。
②若保持乙中压强不变,向甲、乙容器中通入等质量的氦气,达到新平衡时,SO3的体积分数甲 乙。
(2)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图1所示。平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”,下同)。
(3)如图2所示,保持温度不变,将2 mol SO2和1 mol O2加入甲容器中,将4 mol SO3加入乙容器中,隔板K不能移动。此时控制活塞P,使乙的容积为甲的2倍。
①若移动活塞P,使乙的容积和甲相等,达到新平衡时,SO3的体积分数甲
乙。
②若保持乙中压强不变,向甲、乙容器中通入等质量的氦气,达到新平衡时,SO3的体积分数甲 乙。
24.用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯。
(1)完成该反应的化学方程式:(系数按顺序填在答题卷上)
___ C+ ___ KMnO4+ ____ H2SO4→____CO2↑+ ____MnSO4 + ____K2SO4+ ____□
(2)反应的氧化剂是 ,被还原的元素名称是 ;
(3)H2SO4在上述反应中表现出来的性质是 (填选项编号)
A.酸性 B.氧化性 C.吸水性 D.脱水性
(4)上述反应中若产生2.24L(标准状况下)CO2气体,则转移的电子数是 。
23.已知某种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,X元素的原子核外共有20种不同运动状态的电子,Y元素的原子核外共有5种不同能级的电子,且XY2中阳离子和阴离子的电子层结构相同。
(1)该融雪剂的化学式是 ;电子式为: ;
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是 ;D与E能形成一种非极性分子,该分子的结构式为 ;E的单质中,质软有润滑性的是 (填写单质名称)。
(3)元素W在D的同一周期,其单质是原子晶体;元素Z的气态单质分子Z2中有3个共价健;W与Z能形成一种新型无机非金属材料,其化学式可能是 。
(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,R2与NaOH溶液反应的产物之一是OR2,该反应的离子方程式为 。
22.实验室为标定一种烧碱样品的物质的量浓度,称取该烧碱样品4.Og配成1L溶液,取出20.00mL置于锥形瓶中,用0.10mol·L-1 HCl标准溶液滴定,恰好完全中和时消耗标准盐酸19.00mL,若烧碱中只含有一种杂质,则不可能是 A. NaCl B. Ca(OH)2 C. Na2 CO3 D. NaHCO3
第Ⅱ卷(共84分)
21.  化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是
化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是
A.根据图①可判断可逆反应A2(g)+3B2(g) 2AB3(g)正反应是放热反应
2AB3(g)正反应是放热反应
B.图②表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D.根据图④溶解度与溶液pH关系,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO,至pH在4左右。
20.几种短周期元素的原子半径及主要化合价见下表:
|
元素符号 |
X |
Y |
Z |
R |
T |
|
原子半径(nm) |
0.160 |
0.111 |
0.104 |
0.143 |
0.066 |
|
主要化合价 |
+2 |
+2 |
-2,+4,+6 |
+3 |
-2 |
根据表中信息,判断以下说法正确的是 A.单质与稀硫酸反应的速率快慢:R>Y>X B.离子半径:T2->X2+ C.元素最高价氧化物对应的水化物的碱性:Y > R >X D.相同条件下,等物质的量的单质与氢气化合放出能量的多少:T>Z

|
4NH3(g) + 6NO(g)
在恒容密闭容器中,下列有关说法正确的是 A.该反应是放热反应,降低温度将缩短反应达到平衡的时间。
B.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
C.单位时间内消耗NO和N2的物质的量比为6∶5时,反应达到平衡 D.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
19.下列离子方程式书写正确的是
A.氯化镁溶液与氨水反应:Mg2++2OH-® Mg(OH)2↓
B.向Na2CO3溶液中滴入酚酞溶液,溶液变红:CO32--+H2O 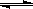 HCO3-+OH-
HCO3-+OH-
C.向Ca(HCO3)2溶液中滴加过量的NaOH溶液:
Ca2++2HCO3-+2OH-→CaCO3↓+CO32-+2H2O
D.向Fe(OH)3悬浊液中加入氢碘酸:Fe(OH)3+3H+®Fe3++3H2O
17.下述实验设计能够达到目的的是
A. SO2中混有少量SO3,通过足量浓硫酸,收集气体
B. HNO3溶液中混有少量H2SO4,加入适量BaCl2溶液,再过滤
C .提取溴水中的溴,可用加入乙醇萃取的方法
D.检验溶液中是否含有Fe2+,向溶液中滴入氯水后,再滴加KSCN溶液
16.下列溶液中微粒浓度关系一定正确的是
A. pH=4的盐酸与pH=10的氨水溶液等体积混合后pH>7
B.氯水中:c(Cl2)=2[c(ClO-)+c(Cl-)+c(HClO)]
C.pH=11的NaOH和pH=11的氨水分别稀释100倍后的pH前者一定大于后者
D. 0.10 mol·L-1 Na2CO3溶液:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com