
题目列表(包括答案和解析)
16.下列叙述正确的是 ( )
A. P4和NO2都是共价化合物
B. CCl4和NH3都是以极性键结合的极性分子
C. 在CaO和SiO2晶体中,都不存在单个小分子
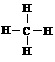
D. 甲烷的结构式: ,是对称的平面结构,所以是非极性分子
15.在下列给定条件的溶液中,一定能大量共存的离子组是( )
A.无色溶液: Ca2+、H+、Cl 、HSO3
、HSO3
B.能使pH试纸呈红色的溶液:Na+、NH4+、Fe2+、NO3
C.FeCl3溶液:K+、Na+、SO42-、SCN-
D.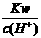 =0.1
mol/L的溶液:Na+、K+、SiO32-、NO3
=0.1
mol/L的溶液:Na+、K+、SiO32-、NO3
14.下列实验操作完全正确的是( )
|
编号 |
实验 |
操作 |
|
A |
钠与水反应 |
用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
|
B |
配制一定浓度的氯化钾溶液1000mL |
准确称取氯化钾固体,放入到1000ml的容量瓶中,加水溶解,振荡摇匀,定容 |
|
C |
为验证NaHCO3固体中是否含Na2CO3 |
取少量待检固体溶于水中,滴加少量BaC12溶液,观察是否有白色沉淀生成 |
|
D |
取出分液漏斗中所需的上层液体 |
下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 |
13.今有室温下四种溶液,有关叙述不正确的是 ( )
|
|
① |
② |
③ |
④ |
|
pH |
11 |
11 |
3 |
3 |
|
溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
A.①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
B.分别加水稀释10倍,四种溶液的pH ①>②>④>③
C.①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D.VaL④与VbL②溶液混合后,若混合后溶液pH=4, 则Va ∶Vb= 11∶9
12.已知25 ℃ 时,AgCl 的溶度积Ksp=1.8×10-10,则下列说法正确的是( )
A.向饱和AgCl水溶液中加入盐酸,Ksp值变大
B.AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-)
C.温度一定时,当溶液中c(Ag+)×c(Cl-)=Ksp时,此溶液中必有AgCl的沉淀析出.
D.AgCl能溶解于氨水中,因为生成了[Ag(NH3)2]Cl
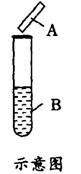
11.用试纸检验气体性质是一种重要的实验方法。如下图所示的实验中,下列试纸选用、现象、对应结论都正确的一项是( )

10.
 一定条件下进行反应 2X(g)+Y(g) Z(s)+3W(g);△H<0。达到平衡后,t1时刻改变某一条件所得V-t图像如图,则改变的条件为 ( )
一定条件下进行反应 2X(g)+Y(g) Z(s)+3W(g);△H<0。达到平衡后,t1时刻改变某一条件所得V-t图像如图,则改变的条件为 ( )
A.增大压强 B.升高温度
C.加催化剂 D.增加生成物浓度
9.氨水中存在着下列平衡:NH3·H2O NH
NH +OH-,若要使平衡向逆反应方向移动,同时使[OH-]增大,应加入的物质是( )
+OH-,若要使平衡向逆反应方向移动,同时使[OH-]增大,应加入的物质是( )
A. NH4Cl固体 B. 硫酸 C. NaOH固体 D. 水
8. NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.2.24L(标准状态)C12与足量NaOH溶液反应,转移电子数为0.2NA
B.2.3g金属钠与足量水反应时失去的电子数是0.1 NA
C. 4.5gSiO2晶体中含有的硅氧键数目为0.15 ×6.02×1023
D.标准状况下,11.2L H2O所含氢原子个数为1 NA
7.下列判断错误的是( )
A.沸点: B.熔点:
B.熔点:
C.酸性: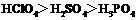 C.碱性:
C.碱性:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com