
题目列表(包括答案和解析)
1.铋(Bi)在医药方面有重要应用。下列关于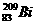 和
和 的说法正确的是 ( )
的说法正确的是 ( )
A.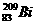 和
和 是同一种核素 B.
是同一种核素 B.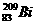 和
和 的中子数相同
的中子数相同
C.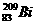 和
和 互称为同位素 D.
互称为同位素 D.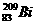 和
和 的质量数相同
的质量数相同
25.(15分)
(1)在上面元素周期表p区中画出金属元素与非金属元素的分界线。
(2)根据NaH的存在,有人提议可将氢元素放在VIIA族,那么根据其最高正价与最低负价的绝对值相等,又可将氢元素放在周期表中的 族。
(3)前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有 种。
(4)X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
|
元素 |
相关信息 |
|
X |
X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
|
Y |
M层上有2对成对电子 |
|
Z |
Z和Y同周期,Z的电负性大于Y |
|
W |
W的一种核素的质量数为63,中子数为34 |
①Y位于元素周期表位置 ,Y和Z的最高价氧化物对应的水化物的酸性较强的
是 (写化学式)。
②XY2是一种常用的溶剂,请写出它的电子式 ,XY2的分子中存在 个σ键。在H―Y、H―Z两种共价键中,键的极性较强的是 。
③Y有两种氧化物其化学式为YO2 和YO3 ,其中YO3中Y原子采用 杂化,YO2分子的空间构型 。
④W的基态原子核外电子排布式是 。现有含W2+的配合物,化学式为[W(H2O)4] SO4·H2O。该配合物中含有的化学键类型 ,该配合物的配体是 。
24. (11分)A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示(部分反应中的H2 O已略去)。请填空:
 (1)若D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不能得到B,则B的化学式可能是________(只写一种)。用有关离子方程式解释 B溶液显酸性的原因是:
。
(1)若D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不能得到B,则B的化学式可能是________(只写一种)。用有关离子方程式解释 B溶液显酸性的原因是:
。
(2)若A是一种碱性气体,常用作制冷剂,B和D为空气的主要成分,则反应②的化学方程式为
。 (3)若D的氯碱工业的主要产品,B有两性,则反应②的离子方程式是 。 (4)若D为酸或酸性气体,则A、C可以是 (请按顺序写出任意一组符合要求的物质的化学式) (5)若C是一种温室气体,D是空气的主要成分之一,1 mol黑色固体A完全燃烧放出393.5kJ热量,1 molB气体完全燃烧放出283.0kJ热量,则A→B反应的热化学方程式为 。
23.(16分)某校综合实践小组用废铁屑制FeCl3,用作印刷电路铜板腐蚀剂,并回收铜。活动过程如下:

(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。
 (2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
装置图:
正极反应 ,
负极反应 。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照下表完成除去CuCl2溶液中Fe3+和Fe2+的实验步骤的相关问题:
①通入足量氯气,目的 ;②加入CuO调节溶液的PH至 ;
③过滤除去 (填化学式)
|
|
氢氧化物开始沉淀时的PH |
氢氧化物沉淀完全时的PH |
|
Fe3+ Fe2+ Cu2+ |
1.9 7.0 4.7 |
3.2 9.0 6.7 |
|
提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu |
(4)学生甲对黄色溶液A和绿色溶液C进行定性实验,完成下表:
|
编号 |
实验内容 |
实验操作 |
预期现象和结论 |
|
① |
检验黄色溶液A中是否含有Fe2+ |
|
|
|
② |
检验绿色溶液C中是否含有Fe3+ |
|
|
(5)电解过程中的阴极材料是 。
(6)采用排液法收集氯气,该液体是 ,原因 。
22. (1 0分)在体积为1 L的密闭容器中,充入1mol CO2和3mol
H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g);测得CO2和CH3OH(g)的浓度随时间变化如图1所示. 该反应过程中的能量变化如图2所示,
CH3OH(g)+H2O(g);测得CO2和CH3OH(g)的浓度随时间变化如图1所示. 该反应过程中的能量变化如图2所示,

图1 图2(有错)
⑴从反应开始到平衡,氢气的平均反应速率v(H2)=___________mol/(L·min).
⑵该反应的平衡常数表达式为__________________.该条件下的平衡常数K=_________(可用分数表示), 温度升高,K值 (填“增大”“不变”或者“减少”)
⑶如果在达平衡后某一时刻保持温度不变,只改变浓度,使c(CO2) =1.00 mol/L,c(H2) = 0.40 mol/L,c(CH3OH) = c(H2O) = 0.80 mol/L,则平衡 (填写序号)。
a.向正反应方向移动 b.向逆反应方向移动
c.不移动 d.无法确定平衡移动方向
⑷下列措施中能使n(CH3OH)/n(CO2)增大的是__________。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
⑸在反应体系中加入催化剂, E1和E2的变化是:E1_________,E2________(填“增大”“减小、”“不变”)。对反应热是否有影响?_______________,原因是 。
21.(8分)化学能的利用是化学研究的重要方面,化学能的利用包括化学能与热能、光能、电能的转化。
(1)化学能与光能的说法不正确的是 (填编号)
A.化石能源是远古太阳能转化为化学能而储存下来的
B.光能转化为化学能最重要的是植物的光合作用
C.利用太阳能分解水制取氢气是光能转化为化学能的过程
D.灯泡通电发光就是灯泡把化学能转化为光能的过程
(2)化学能与热能
已知:①1molH2分子中化学键断裂时需要吸收436kJ的能量②1molCl2分子中化学键断裂时需要吸收243kJ的能量③由H原子和Cl原子形成1molHCl分子时释放431kJ的能量。请写出氢气和氯气反应生成氯化氢气体的热化学方程式是 。
(3)化学能与电能
 ①以H2为燃料可制成氢氧燃料电池。 已知 2H2(g)+O2(g)===2H2O(I) △H=-572KJ.mol-1
①以H2为燃料可制成氢氧燃料电池。 已知 2H2(g)+O2(g)===2H2O(I) △H=-572KJ.mol-1
某氢氧燃料电池释放228.8KJ电能时,生成1mol液态水,该电池的能量转化率为 。
②右图是某笔记本电脑用一个乙醇燃料电池工作时的示意图。乙池中的两个电极均为石墨电极,乙池中盛有100 mL3.00 mol/L的CuSO4溶液。请回答下列问题:
a. 通入O2的电极的电极反应式是 。
b.在此过程中,若乙池中两电极产生的气体恰好相等时(假设标准状况下),理论上需通入
克乙醇
20.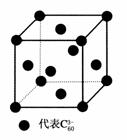 自1990年以来,对C60的研究报道很多,其中有碱金属K与C60在回流的甲苯中搅拌反应,得到碱金属化合物K3C60。其晶体是由K+和C所构成的离子晶体,如图是K3C60的一个晶胞结构图,其中仅标出了C在晶胞中的分布(为面心立方体),该晶胞中含K+数为 ( )
自1990年以来,对C60的研究报道很多,其中有碱金属K与C60在回流的甲苯中搅拌反应,得到碱金属化合物K3C60。其晶体是由K+和C所构成的离子晶体,如图是K3C60的一个晶胞结构图,其中仅标出了C在晶胞中的分布(为面心立方体),该晶胞中含K+数为 ( )
A.12个 B.8个
C.4个 D.3个
19.下列说法正确的是( )
A.用量筒量取10.00mL的0.1000 mol/L NaOH 溶液
B. 用0.1000 mol/L NaOH溶液滴定未知浓度的醋酸溶液,可选甲基橙做指示剂
C. 用已知浓度的盐酸滴定未知浓度的NaOH溶液,若滴定前仰视,滴定后俯视,会使测定结果偏低
D. 液面在“0”刻度时,50mL碱式滴定管和25mL碱式滴定管所盛液体的体积比值等于2 :1
18. 可逆反应2A+B
可逆反应2A+B 2C(g);△H<0随T(℃)变化气体平均相对分子质量Mr的变化如图所示,则下列叙述中正确的是( )
2C(g);△H<0随T(℃)变化气体平均相对分子质量Mr的变化如图所示,则下列叙述中正确的是( )
A. A和B可能都是固体 B. A和B一定都是气体
C. A和B不可能都是气体 D. 若B为固体,则A一定为气体
17.下列说法正确的是( )
A.已知反应CH4(g)+2O2(g)=CO2(g)+2H2O(l) ,其ΔS>0
B.已知反应X+Y= M+N为放热反应, X和Y的总能量一定高于M和N的总能量
C.活化分子之间发生的碰撞一定为有效碰撞
D.对有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com