
题目列表(包括答案和解析)
21.(8分)下图中各方框中的字母表示有关的一种反应物或生成物(某些物质略去)其中常温
下B、D、G、I、J为气体,其中B可使湿润的红色石蕊试纸变蓝,A-N的所有物质中只
有G为单质,其余为化合物。N为不溶于水的无机酸。

请回答下列问题:
(1) 写出下列物质的化学式
A:_______________F:____________L:________________
(2) 写出G的一种同素异形体的化学式:
(3)已知工业上生产0.1molB放出4.62kj热量,写出该反应的热化学方程式:
(4)在反应C+E→G+F中,每生成1molG转移 mol电子。
20.(9分)在一容积为2 L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,反应中NH3的物质的量浓度的变化情况如下图:
2NH3(g) ΔH<0,反应中NH3的物质的量浓度的变化情况如下图:

请回答下列问题:
(1)该反应的化学平衡常数K表达式为______________________;
升高温度K值 (填“变大”、“变小”或“不变”)
(2)根据上图,计算从反应开始到平衡时,平均反应速率v(H2)为____________。
(3)判断该反应达到平衡状态的标志是 (填字母);
a.N2和NH3浓度相等 b.NH3百分含量保持不变
c.容器中气体的压强不变 d.NH3的生成速率与H2的消耗速率相等
e.容器中混合气体的密度保持不变
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为_______________。
a. 0.20 mol/L b. 0.12 mol/L c. 0.10 mol/L d.0.08 mol/L
(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol/L),请在上图中画出第5分钟末达到此平衡时NH3浓度的变化曲线。
19.(7分)(1)某厂废水中含KCN,其浓度为650mg·L-1现用氯氧化法处理,发生如下反应(其中N均为-3价):KCN+2KOH+Cl2=KOCN+2KCl+H2O被氧化的元素是_________。
(2)若将等浓度等体积的KCN与HCN混合,测得溶液中c(K+)>c(CN-),则该溶液的pH______7,要使c(K+)=c(CN-),应采取的措施是____________________________.。
(3)若将10m3含KCN的浓度为650mg·L-1的废水中KCN氧化除去,需要标准状况下的氯气的体积为____________L。
(4)已知:Fe2O3(s)+C(s)= CO2(g)+2Fe(s) △H=+234.1kJ·mol-1
C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1
则2Fe(s)+O2(g) =Fe2O3(s)的△H是_________________。
18.(11分)孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。以孔雀石为原料可制备CuSO4·5H2O及纳米材料G,步骤如下:

请回答下列问题:
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中,试剂①最佳为 (填代号),检验溶液A中Fe3+的最佳试剂为 (填代号)。
a.KMnO4 b.(NH4)2S c.H2O2 d.KSCN
沉淀D中除了过量的CuO外,还存在另一种固体,其化学式为 。加
入CuO作用是 ____________________________________ 。
(2)由溶液C获得CuSO4·5H2O,需要经过一系列操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是 。
(3)制备纳米材料G时,应向CaCl2溶液中先通入(或先加入) (填化学式)。
写出该反应的化学方程式 __________________________ 。
(4)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液滴定,取用KMnO4标准溶液
应用______________(填写仪器名称);取A溶液稀释一定倍数后,用KMnO4标
准溶液滴定,终点现象为 。
17. (8分)A、B、C、D、E、F均为短周期元素,其原子序数依次增大。已知:A的最外层电子数等于其电子层数;B的最外层电子数是次外层电子数的两倍;D是地壳中含量最高的元素;D和F、A和E分别同主族;E是所有短周期主族元素中原子半径最大的元素。根据以上信息回答下列问题:
(1)B与D形成化合物BD2的结构式为 。
(2)A、C、D三元素能形成一种强酸甲,写出单质B与甲的浓溶液反应的化学反应方程式 。 FB2气体通入BaCl2和甲的混合溶液,生成白色沉淀和无色气体CD,有关反应的离子方程式为
___________________________________________。
(3)均由A、D、E、F四种元素组成的两种盐,其相对分子质量相差16,写出它们在溶液中相互作用的离子方程式为__________________________________________; 由B、D、E组成的盐溶于水后溶液显碱性,其原因是(用离子方程式表示)____________________________________________________________________。
(4)C2A4 ─ 空气燃料电池是一种碱性燃料电池。电解质溶液是20%-30%的KOH溶液。则燃料电池放电时,负极的电极反应式为__________________________________.。
16.如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解。假设在电解过程中产生的气体全部逸出,下列说法正确的是。 ( )

A.甲、乙两烧杯中溶液的pH均升高
B.当b极增重5.4g时,d极产生的气体为2.24L(标准状况)
C.当电解一段时间后,将甲、乙两溶液混合,一定会生成沉淀
D.乙烧杯中c的电极反应式为2Cl--2e-=Cl2↑
Ⅱ卷
15.往一体积不变的密闭容器中充入H2和I2,发生反应H2(g)
+ I2(g)  2HI(g);
2HI(g); ,当达到平衡后,t0 时若保持混合气体总物质的量不变而改变某一反应条件,使容器内压强增大(如图所示),下列说法正确的是 。
( )
,当达到平衡后,t0 时若保持混合气体总物质的量不变而改变某一反应条件,使容器内压强增大(如图所示),下列说法正确的是 。
( )
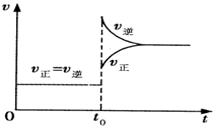
A.容器内气体颜色变深,平均相对分子质量不变
B.平衡不移动,混合气体密度增大
C.H2转化率增大,HI平衡浓度减小
D.t0 时减小体积或升高体系温度
14.有一无色溶液,可能含有K+、A13+、Mg2+、NH4+、Cl-、SO42-、HCO3-、MnO4-中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断正确的 。( )
A.肯定有A13+、Mg2+、NH4+、Cl- B.肯定有Al3+、Mg2+、HCO3-
C.肯定有K+、HCO3-、MnO4- D.肯定有A13+、Mg2+、SO42-
13.在恒压密闭容器M(如图Ⅰ)和恒容密闭容器N(如图Ⅱ)中,分别加入a
molA和a
molB,起始时两容器体积均为V L,发生如下反应并达到化学平衡状态:2A(?)+ B(?) xC(g);ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断正确的是。( )
xC(g);ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断正确的是。( )
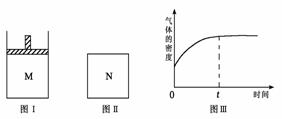
A.x =4
B.若N中气体的密度如图Ⅲ所示,则A、B都是气态
C.若A为气体,B为非气体,则平衡时M、N中C的物质的量相等
D.若A、B均为气体,平衡时M中A的转化率小于N中A的转化率
12. 某二元酸(H2A)按下式发生电离:H2A=H++HA-;HA- H++A2-。关于下列四种溶液的说法正确的是
( )
H++A2-。关于下列四种溶液的说法正确的是
( )
①0.01mol/L的H2A溶液;②0.01mol/L的NaHA溶液;③0.02mol/L的HCl溶液与0.04mol/L的NaHA溶液等体积混合;④0.02mol/L的NaOH溶液与0.02mol/L的NaHA溶液等体积混合;
A.四种溶液中c(HA-)浓度大小:③>②>①>④
B.溶液①中一定不存在OH-
C.溶液②中存在水解平衡:HA-+H2O H2A+OH-
H2A+OH-
D.溶液③中有关离子浓度关系:c(HA-)+c(A2-)=c(Na+)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com