
题目列表(包括答案和解析)
5.从下列事实所列出的相应结论正确的是
|
|
实 验 事 实 |
结 论 |
|
A |
Cl2的水溶液可以导电 |
Cl2是电解质 |
|
B |
SO2通入硝酸钡溶液出现白色沉淀 |
BaSO3不溶于强酸 |
|
C |
NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 |
酸性:HCO3->H3AlO3 |
|
D |
常温下白磷可自燃而氮气须在放电时才与氧气反应 |
非金属性:P>N |
4.下列各选项所述的两个量,前者一定大于后者的是
①F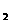 和Br
和Br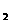 的沸点 ②纯水在25℃和80℃时的pH
的沸点 ②纯水在25℃和80℃时的pH
③同温下分别在100 g水中最多能溶解的无水CuSO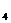 和CuSO
和CuSO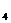 · 5H
· 5H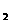 O的质量
O的质量
④25℃时,等体积且pH都等于5的盐酸和AlCl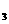 溶液中,已电离的水分子数
溶液中,已电离的水分子数
⑤在NH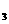 +NO-→ N
+NO-→ N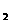 +H
+H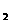 O(未配平)反应中,被氧化和被还原的N 原子数
O(未配平)反应中,被氧化和被还原的N 原子数
⑥耐火材料MgO和CaO的熔点 ⑦H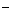 和H
和H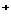 的离子半径
的离子半径
A.①②④ B.②③⑤ C.②⑥⑦ D.⑤⑥⑦
3.最新研究表明生命起源于火山爆发,是因为火山爆发产生的气体中含有1%的羰基硫(COS),已知羰基硫分子中所有原子的最外层都满足8电子结构,结合已学知识,可以得到的正确结论是
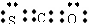 A.羰基硫属于非极性分子
A.羰基硫属于非极性分子
B.羰基硫的电子式为:
C.羰基硫沸点比CO2低
D.羰基硫分子中三个原子不在同一直线上
2.正确掌握化学用语是学好化学的基础。下列有关表述中正确的一组是
A.C2H4和C4H8两物质中碳的质量分数相同,它们一定是同系物
B.16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体
C.S2-的结构示意图为: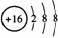 ,NH4Cl的电子式为:
,NH4Cl的电子式为: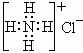
D.SiH4、CH4、NH4+的空间构型均为正四面体型;CO2、C2H2均为直线型
1.2006年9月28日,中国科学家研制的“人造太阳”成功地进行了一次放电。所谓“人造太阳”是指受控核聚变。从1 L海水中提取出来的氘(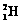 )受控核聚变成氦(
)受控核聚变成氦(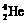 )时产生的能量相当于300 L汽油燃烧放出的能量。因此这种技术对解决能源问题有着十分广阔的发展前景。下列有关说法正确的是
)时产生的能量相当于300 L汽油燃烧放出的能量。因此这种技术对解决能源问题有着十分广阔的发展前景。下列有关说法正确的是
A.氘(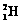 )受控核聚变成氦(
)受控核聚变成氦(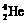 )是一种化学变化
)是一种化学变化
B.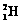 和
和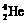 互为同位素
互为同位素
C.符号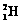 中的“2”与符号
中的“2”与符号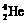 中的“2”意义不同
中的“2”意义不同
D.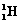 2和
2和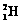 2的物理性质、化学性质都存在着很大的差异
2的物理性质、化学性质都存在着很大的差异
35.有H2SO4和HCl的混合溶液20mL,加入0.025mol·L-1Ba(OH)2溶液时,生成沉淀的质量W(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示(C点混合液pH=7),求:
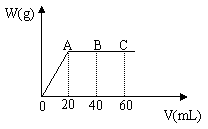 ⑴原混合液中H2SO4和HCl的物质的量浓度
⑴原混合液中H2SO4和HCl的物质的量浓度
⑵A点和B点时溶液的pH。
-5-
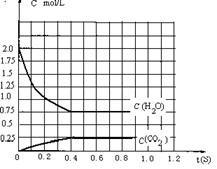
34.
 在完全满足可逆反应:2H2O(g) 2H2+O2,2CO+O2 2CO2能顺利进行的条件下,将2molH2O(g)和2molCO充入1L密闭容器中,使其发生反应,一段时间后反应达到平衡。反应过程中部分气体浓度随时间t的变化情况如下图所示:
在完全满足可逆反应:2H2O(g) 2H2+O2,2CO+O2 2CO2能顺利进行的条件下,将2molH2O(g)和2molCO充入1L密闭容器中,使其发生反应,一段时间后反应达到平衡。反应过程中部分气体浓度随时间t的变化情况如下图所示:
⑴请在图中画出c(H2) 随时间t的变化曲线图;
⑵平衡时 c (O2)平为 0.5mol /L mol/L。
⑶欲计算出平衡时O2的浓度,除已知“H2O(g)和CO”
-4-
的物质的量外,至少需要知道平衡体系中某两种气体的平衡浓度。这两种气体除可以是H2O和CO2外还可以是H和CO(或H和CO或HO和CO) 。
⑷在其它条件不变的情况下,若改为起始时在容器中充入2molH2和2molCO2,则上述两反应达到平衡时,c (O2)平= 0.5mol mol/L。
33. 今有a、盐酸;b、硫酸;c、醋酸三种酸:
⑴在同体积,同pH的三种酸中,分别加入足量的碳酸钠粉末, 在相同条件下产生CO2的体积由大到小的顺序是__c>a=b____。
⑵在同体积、同浓度的三种酸中,分别加入足量的碳酸钠粉末,在相同条件下产生CO2的体积由大到小的顺序是__b>a=c____。
 ⑶物质的量浓度为0.1 mol·L-1的三种酸溶液的pH由大到小的顺序是__c>a>b__ ;如果取等体积的0.1 mol·L-1的三种酸溶液,用0.1 mol·L-1的 NaOH溶液中和,当恰好完全反应时,消耗NaOH溶液的体积由大到小的顺序是 b>a=c (填序号)。
⑶物质的量浓度为0.1 mol·L-1的三种酸溶液的pH由大到小的顺序是__c>a>b__ ;如果取等体积的0.1 mol·L-1的三种酸溶液,用0.1 mol·L-1的 NaOH溶液中和,当恰好完全反应时,消耗NaOH溶液的体积由大到小的顺序是 b>a=c (填序号)。
( D )20.下列叙述正确的是
A pH=3和pH=4的盐酸各10mL混合,所得溶液的pH=3.5
B 溶液中[H+]越大,pH值也越大,溶液的酸性就越强
C 液氯虽然不导电,但溶解于水后导电情况良好,因此,液氯也是强电解质
D 当温度不变时,在纯水中加入强碱溶液不会影响水的离子积常数
(CD)21.在25℃时,某稀溶液中由水电离产生的[H+]=10-13mol/L。下列有关该溶液的叙述正确的是
A. 该溶液一定呈酸性 B. 该溶液一定呈碱性
C. 该溶液的pH值可能为1 D. 该溶液的pH值可能为13
(BD)22. 下列溶液中,pH>8的是
A. 0.1mol/L氨水跟0.1mol/L盐酸等体积混合后的溶液
B. 将pH=12的NaOH溶液稀释至100倍后所得到的溶液
C. 将pH=5的醋酸溶液稀释至10000倍后所得到的溶液
D. c(OH-)=10-6mol/L的NaOH溶液10mL加入浓度10-5mol/L的NaOH溶液100mL后的溶液
(CD)23.浓度都是0.2mol/L的盐酸(甲)和醋酸溶液(乙)各50mL,分别加入等体积的0.1mol/L的烧碱溶液。以下关于反应后甲、乙两杯溶液的说明,错误的是
A. 甲溶液的pH在1-2之间 B. 甲溶液的pH较乙小
C. 甲溶液的pH较乙大 D. 乙溶液的pH仍然小于7
(BC)24.向一定体积的0.1摩/升的醋酸溶液中加入等体积的蒸馏水后,则下列叙述正确的是
A.溶液的pH值变小 B.醋酸的电离度增大
C.溶液的导电能力减弱 D.中和此溶液所需的0.1摩/升NaOH溶液的体积增加
( D )25.下列溶液,一定呈中性的是
A. 由等体积、等物质的量浓度的一元酸跟氢氧化钠溶液混合后所形成的溶液
B. [H+]=1×10-7mol·L-1 的溶液
C. pH=14-pOH 的溶液
( A )26. 下列说法中正确的是
A.在25℃纯水中,c(H+)=c(OH-)=10-7 mol/L,呈中性
B.溶液中,若c(H+) > 10-7 mol/L,则c(H+) > c(OH-),呈酸性
C.c(H+)越大,则pH越大,溶液的碱性越强
D.pH为0的溶液,其中只有H+而无OH-
( A )27. 下列四种溶液中,由水电离生成的氢离子浓度之比(①∶②∶③∶④)是:①1mol/L的盐酸;②0.1 mol·L-1的盐酸;③0.01 mol·L-1的NaOH溶液;④0.001mol/L的NaOH溶液
-3-
A.1:10:100:1000 B.0:1:12:11
C.14:13:12:11 D. 14:13:2:3
( C )28. 中和相同体积,相同pH的Ba(OH)2、NaOH、和NH3·H2O三种稀溶液所用相同浓度的盐酸的体积分别为V1、V2、V3则三者关系为
A.V3﹥V2﹥V1 B.V3 = V2﹥V1 C.V3﹥V2 = V1 D.V1 = V2﹥V3
(BC)29.恒温恒压下,在容积可变的密闭容器中发生反应:A(g) + B(g) C(g)。若开始时通入1molA和1mol B,达到平衡后生成a mol C,则下列说法错误的是
C(g)。若开始时通入1molA和1mol B,达到平衡后生成a mol C,则下列说法错误的是
A.若开始通入3mol A和3mol B,达到平衡后将生成3a mol C
B.若开始通入x mol A、2mol B和1mol C,达到平衡后密闭容器中有1mol A和3mol C,则x为3
C.若开始时通入4 mol A、2 mol B和1 mol C,达到平衡时,B的物质的量一定大于2mol
D.若开始时通入2molA、2 mol B和1 mol C,达到平衡后,再通入3 mol则再次到达平衡后,C的物质的量分数为a/(2-a)
( C )30. 取等质量的单质A和化合物B两种固体,分别投入足量的水中,产生C、D两种气体。一定条件下,C和D恰好可完全反应,则下列叙述中正确的是
A. 1 molA和1 molB的质量相同 B. 1 molA和1 molB中所含的质子数相同
C. 1molA和1/2molB所含的电子数相同 D. 1/2molA和1molB中所含的中子数相同
(AB)31.在一定温度下,可逆反应N2+3H2 2NH3达到平衡的标志是
2NH3达到平衡的标志是
A.1个N≡N键断裂的同时,有6个N-H键断裂 B.N2、H2、NH3的体积分数不再变化
C.N2、H2、NH3的物质的量浓度相等 D.N2、H2、NH3的分子数之比为1:3:2
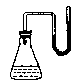 (A)32.把下列物质分别加入盛水的锥形瓶内,立即塞紧带U形管的塞子。已知U形管内预先装有少量水且液面相平(为便于观察,预先染成红色),加入下列哪些物质后,发生如图所示变化①NaOH粉末;②18mol/L的H2SO4溶液;③NH4NO3晶体;④Na2O2固体;⑤生石灰
(A)32.把下列物质分别加入盛水的锥形瓶内,立即塞紧带U形管的塞子。已知U形管内预先装有少量水且液面相平(为便于观察,预先染成红色),加入下列哪些物质后,发生如图所示变化①NaOH粉末;②18mol/L的H2SO4溶液;③NH4NO3晶体;④Na2O2固体;⑤生石灰
A.①②④⑤ B.①②③ C.②③⑤ D.③④⑤
19. 下图所涉及的物质均为中学化学中的常见物质,其中C为O2、D为C12、E为Fe单质,其余为化合物.它们存在如下转化关系,反应中生成的水及次要产物均已略去。
-2-
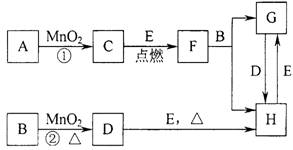 ⑴写出有关物质的名称或化学式:
⑴写出有关物质的名称或化学式:
B:HCl ,F:FeO ,H: FeCl 。
⑵指出MnO2在相关反应中的作用:反应①中是 催化 剂,反应②中是 氧化 剂.
⑶若反应①是在加热条件下进行,则A是 KClO ;若反应①是在常温条件下进行,A是HO 。
⑷写出B与MnO2共热获得D的化学方程式:MnO+4HCl(浓)MnCl+C1↑+2HO 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com