
题目列表(包括答案和解析)
23.一定温度下,lmol X和n mol Y在体积为2L的密闭容器中发生如下反应:
X(g)+Y(g) 2Z(g)+M(s),5min后达到平衡,此时生成2a mol Z。下列说法正确的是 ( )
2Z(g)+M(s),5min后达到平衡,此时生成2a mol Z。下列说法正确的是 ( )
A.用X表示此反应的反应速率是(0.1-0.2a)mol/(L·min)
B.向平衡后的体系中加入lmol M,平衡向逆反应方向移动
C.当混合气体的质量不再发生变化时,说明反应达到平衡状态
D.向上述平衡体系中再充入lmol X,v (正)增大,v (逆)减小,平衡正向移动
[答案]C
[解析]用Z表示此反应的反应速率是2a/(2×5)=0.2a mol/(L·min),v (X)=v (Z)/2=0.1a mol/(L·min),A错。由于M是固体,故M的加入不影响化学平衡,B错。向上述平衡体系中再充入lmol X时,v (正)增大,v (逆)也增大,D错
[考点]化学反应速率和化学平衡
22.某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:
3A(g)+2B(g) 4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol
C,则下列说法正确的是 ( )
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol
C,则下列说法正确的是 ( )
A.该反应的化学平衡常数表达式是K=
B.此时B的平衡转化率是40%
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.增加B,平衡向右移动,B的平衡转化率增大
[答案]B
[解析]由于反应中C是固体,因此不应计入平衡常数表达式中,A错。化学平衡常数只与温度有关,因此改变压强,平衡常数不变,C错。增加B,平衡向右移动,但B的平衡转化率将减小,D错。
[考点]化学反应速率和化学平衡
21.下图表示的是难溶氢氧化物在不同pH下的溶解度(S/mol·L-1),下列说法中正确的是
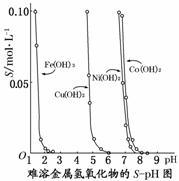 ( )
( )
A.pH=3时溶液中铁元素的主要存在形式是Fe3+
B.若Ni(NO3)2溶液中含有少量的Co2+杂质,可通过调节溶液pH的方法来除去
C.若分离溶液中的Fe3+和Cu2+,可调节溶液的pH在4左右
D.若在含有Cu2+和Ni2+的溶液中加入烧碱,Ni(OH)2优先沉淀
[答案]C
[解析]当pH=3时,Fe3+已沉淀完全,A错。由于Ni2+和Co2+完全沉淀时pH相差不大,故不宜采用调节溶液pH的方法来除去,B错。根据图示可知在含有Cu2+和Ni2+的溶液中加入烧碱,Cu(OH)2优先沉淀,D错。
[考点]电解质溶液--沉淀溶解平衡
20.某有机物是药物生产的中间体,其结构简式如图。下列有关叙述正确的是 ( )

A.该有机物与溴水发生加成反应
B.该有机物与浓硫酸混合加热可发生消去反应
C.1 mol该有机物与足量NaOH溶液反应最多消耗3 mol NaOH
D.该有机物经催化氧化后能发生银镜反应
[答案]D
[解析]该有机物不能与溴水发生加成反应,但能发生苯环上的取代反应,A错。由于醇羟基上邻碳无氢,故不能发生消去反应,B错。能和NaOH溶液反应的官能团有酚羟基、酯基和卤原子,完全反应共需NaOH4mol,C错。
[考点]有机化学基础
19.现有四种短周期元素的有关信息如下表所示:
|
元素 |
结构特点及在周期表中的位置 |
单质及化合物的部分性质与用途 |
|
甲 |
在元素周期表中,主族序数等于周期数 |
工业上用电解法冶炼该金属 |
|
乙 |
单质的晶体类型为原子晶体 |
氧化物是工业制普通玻璃的主要原料 |
|
丙 |
原子最外层电子数是最内层电子数的2倍 |
单质存在多种同素异形体 |
|
丁 |
元素能形成两种不同的阴离子 |
丁的一种单质与KI溶液反应生成另一种丁的单质 |
则甲、乙、丙、丁四种元素的原子序数从大到小排列的是 ( )
A.甲、乙、丙、丁 B.丁、甲、乙、丙
C.丙、丁、甲、乙 D.乙、甲、丁、丙
[答案]B
[解析]根据表中信息,甲是Al,乙是Si,丙是C,丁是O,丁的一种单质与KI溶液反应生成另一种丁的单质的化学方程式可表示为O3+2KI+H2O =2KOH+O2+I2。由此可知选项D正确。
[考点]物质结构、元素周期律
18.在25ºC时,将两根铂电极插入一定量的硫酸钠饱和溶液中进行电解,当电路中有a mol电子转移时,溶液中析出mg Na2SO4 ·10 H2 O晶体。若温度不变,在剩余溶液中溶质的质量分数为 ( )
A.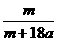 ×100%
B.
×100%
B.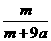 ×100%
×100%
C.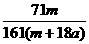 ×100%
D.
×100%
D.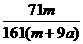 ×100%
×100%
[答案]D
[解析]当用惰性电极电解饱和Na2SO4溶液时,电解总反应式为2H2O 2H2↑+O2↑,该反应中共转移4mol电子,因此当有amol电子转移时,电解过程中共消耗0.5amol的水,由于原溶液是饱和溶液,电解后的溶液也是饱和溶液,故饱和溶液质量分数的计算可作如下转化:mg晶体中Na2SO4的质量溶解在mg晶体中的水和0.5amol水中恰好饱和,由此可计算得选项D正确。
2H2↑+O2↑,该反应中共转移4mol电子,因此当有amol电子转移时,电解过程中共消耗0.5amol的水,由于原溶液是饱和溶液,电解后的溶液也是饱和溶液,故饱和溶液质量分数的计算可作如下转化:mg晶体中Na2SO4的质量溶解在mg晶体中的水和0.5amol水中恰好饱和,由此可计算得选项D正确。
[考点]化学计算与技巧
17.把3体积NO2气体依次通过①NaHCO3溶液(饱和);②浓H2SO4;③Na2O2后(假设每一步的作用都是充分的),再用排水法收集残留气体,则收集到的气体是 ( )
A.1体积NO B.1体积NO2和0.5体积O2
C.0.25体积O2 D.1/3体积的NO
[答案]C
[解析]设有3molNO2气体,当通过NaHCO3溶液时,可看作先和水反应生成HNO3,生成的酸再和NaHCO3反应,因此共有2molCO2和1molNO气体逸出。再通过浓H2SO4,相当于对气体进行干燥。最后通过Na2O2时,可看作2molCO2先与Na2O2反应生成1molO2,后发生2NO+O2=2NO2,故此时残余1molNO2和0.5molO2。当最后用排水法收集时,发生反应4NO2+O2+2H2O=4HNO3,可计算得残余0.25molO2,根据相同条件下气体的体积之比等于物质的量之比可知选项C符合题意。
[考点]非金属元素及其化合物
16.向一定量的Mg2+、NH4+、Al3+混合溶液中加入Na2O2的量与生成沉淀和气体的量(纵坐标)的关系如图所示,则溶液中三种离子的物质的量之比为 ( )
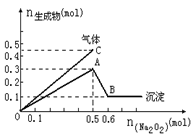
A.1∶1∶2 B.1∶2∶2 C.2∶2∶1 D.9∶2∶4
[答案]B
[解析]由图知沉淀中含0.1mol Mg(OH)2和0.2mol Al(OH)3,即原溶液中含Mg2+0.1mol,含Al3+0.2mol,则沉淀2种金属阳离子共需NaOH0.8mol。由图中横坐标知与3种阳离子恰好完全反应时需Na2O20.5mol,而0.5molNa2O2与水反应生成1molNaOH和0.25molO2,由NH4+消耗NaOH的量或生成NH3的体积均可求得原溶液中含0.2molNH4+,故选项B正确。
[考点]元素及其化合物
15.下列说法错误的是 ( )
A.从CH4、NH4+、SO42-为正四面体结构,可推测PH4+、PO43-也为正四面体结构
 B.1mol金刚石晶体中,平均含有2mol C-C键
B.1mol金刚石晶体中,平均含有2mol C-C键
C.水的沸点比硫化氢的高,是因为H2O分子间存在氢键,H2S
分子间不能形成氢键
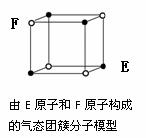
D.某气态团簇分子结构如右图所示,该气态团簇分子的分子
式为EF或FE
[答案]D
[解析]根据等电子体的概念可知选项A正确。金刚石中碳原子形成空间网状
的正四面体结构,故B正确。选项C显然是正确的。选项D中强调该物质
是气态团簇分子,即是一个大分子,因此不能用均摊法计算,直接找出分子中原子个数即得化学式,
该物质的化学式应为(EF)4,选项D错。
[考点]物质结构与性质
14.下列关于四个图像的说法正确的是 ( )
|
|



① ②
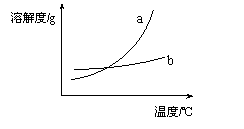

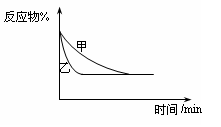

③ ④
A.图①表示化学反应中能量的变化,反应CO(g)+H2O(g)= CO2(g)+H2(g)的△H>0
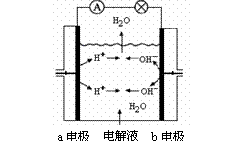
B.图②为氢氧燃料电池示意图,正、负极通入的气体体积之比为2︰1
C.图③表示物质a、b的溶解度曲线,可以用结晶方法从a、b 混合物中提纯a
D.图④可以表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,且乙的压强大
3C(g)+D(s)的影响,且乙的压强大
[答案]C
[解析]图①表示反应物的总能量高于生成物的总能量,因此该反应为放热反应△H<0,A错。图② 氢氧燃料电池的总反应式为2H2+O2=2H2O,正极发生还原反应,通入O2,负极发生氧化反应,通入H2,故正负极通入的气体体积之比为1:2,B错,选项D注意到生成物D是固体,该反应是气体体积不等的反应,因此不合要求。应选C。
[考点]化学反应速率与化学平衡、电化学
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com