
题目列表(包括答案和解析)
22.(8分)已知KMnO4、MnO2在酸性条件下均能将草
酸钠(Na2C2O4)氧化:
2MnO4-十5C2O242--+16H+=2Mn2++10CO2↑+8H2O
MnO2+ C2O42-+ 4H+= Mn2十+2CO2↑+2H2O
某研究小组为测定某软锰矿中Mri02的质量分数,
准确称取1.20g软锰矿样品,加入2.68g草酸钠
固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应之后冷却、滤去杂质,将所得溶液转移到250ml容量瓶中并定容;从中取出25.00mL待测液置于锥形瓶中,再用0.0200moI.L-lKMn04标准溶液进行滴定,当滴入20.00mil·L KMnO4溶液时恰好完全反应。
试回答下列问题:
(1)0,0200FrioI.lL-lKMif104标准溶液应置于 (选填“甲”或“乙”)滴定管中;滴定终点如何判断____
(2)帮助该研究小组求得软锰矿中Mr102的质量分数为
(3)若在实验过程中存在下列操作,其中会使所测Mn02的质量分数偏小的是_ __。
A.溶液‘转移至容量瓶中,未将烧杯、玻棒洗涤
 B.滴定H滴定管尖嘴部分有一气泡,滴定终点时消失
B.滴定H滴定管尖嘴部分有一气泡,滴定终点时消失
C.定容时,俯视刻度线
D.滴定前仰视读数,滴定后俯视读数
E.锥形瓶水洗之屙未用待测液润洗
21.(2分)下列实验操作正确的是
A.用试管夹夹持试管时,试管夹从试管底部往上套,夹在试管的中部
B.将滴管垂直伸进试管内滴加液体
C.将试管平放,用纸槽往试管里送入固体粉末后,然后竖立试管
D.硝酸、氯水盛放在棕色的试剂瓶中
 E.熔融氢氧化钠要在耐高温的石英坩埚中
E.熔融氢氧化钠要在耐高温的石英坩埚中
20.如图装置进行实验,将液体A逐滴加入到
 固体B中,下列叙述正确的是( )
固体B中,下列叙述正确的是( )
A.若A为浓盐酸,B为MnO2,C中盛
品红溶液,则C中溶液褪色
B.若A为醋酸,B为贝壳,C中盛氯化
钙溶液,则C中溶液变浑浊
C.若A为浓氨水,B为生石灰,C中盛
A1C13溶液,则C中先产生白色沉淀
后沉淀又溶解
D.实验仪器D可以起到防止溶液倒吸的作用
第II卷(非选择题共50分)
说明;
将第Ⅱ卷的答案用黑色或蓝色钢笔或中性笔答在答题纸规定位置处,答案仅答在试卷上不予评分。
19.醋酸钡[(CH3COO)2Ba·H2O]是一种媒染剂,有关0.1mol/L醋酸钡溶液中粒子浓度比较不正确的是 ( )
A.c(Ba2+)>c(CH3COO-)>c(OH-)>c(H+)
B.c(H+)+2c(Ba2+)=c(CH3COO-)+c(H+)
C.c(H+)=c(OH-)-c(CH3COOH)
D.2c(Ba2+)=c(CH3COO-)+c(CH3COOH)
18.下列有关说法中,正确的是 ( )
A.强电解质在水中溶解度一定大于弱电解质在水中的溶解度
B.将20℃时KC1溶液降低温度,所得溶液的质量分数一定会减小
C.依据能否发生丁达尔效应鉴别胶体与溶液
D.氯气的水溶液能导电,但C12是非电解质
17.在一定温度下,将一定质量的冰醋酸加水稀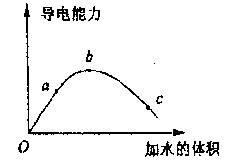
释的过程中,溶液导电性的变化如右下图所
示。下列有关说法正确的是 ( )
A.a、b、c三点溶液的pH:a>b>c
B.若用湿润的pH试纸测试c处溶液的
pH,比实际的pH偏小
C.a、b、c三点溶液用1mol/L的NaOH
溶液中和,消耗NaOH溶液的体积a>b>c
D.若向c处的溶液中加入醋酸钠固体,醋酸的电离程度减小,溶液导电性增强
15.下列实验不能达到预期目的的是 ( )
|
序号 |
实验操作 |
实验目的 |
|
A |
Cl2、Br2分别与H2反应 |
比较氯、溴的非金属性强弱 |
|
B |
MgCl2、AlCl3溶液中分别通入NH3 |
比较镁、铝的金属性强弱 |
|
C |
测定Na2CO3、Na2SO4两溶液的pH |
比较碳、硫的非金属性强弱 |
|
D |
用同一电路测定等浓度的盐酸、醋酸两溶液的导电性 |
比较盐酸、醋酸的酸性强弱 |
 l6.右图为阳离子交换膜法电解饱和食盐水原
l6.右图为阳离子交换膜法电解饱和食盐水原
理示意图。下列说法不正确的是( )
A.从E口逸出的气体是H2
B.从B口加入含少量NaOH的水溶液以
增强导电性
C.标准状况下每生成22.4LC12,便产生
2molNaOH
D.粗盐水中含Ca2+、Mg2+、Fe2+、SO42-等离子,精制时先加Na2CO3溶液
14.美国加州Miramal海军航空站安装了一台250kW的MCFC型燃料电池,该电池可同时供应电和水蒸气,其工作温度为600℃-700℃,所用燃料为H2,电解质为熔融的K2CO3。该电池的总反应为:2H2+O2 2H2O,负极反应为:H2+CO32-→H2O+CO2+2e-。
则下列推断中,正确的是 ( )
A.正极反应为4OH-4e-→2H2O+O2↑
B.当电池生成1mol水时,转移4mol电子
C.放电时CO32-向负极移动
D.放电时电子向负极移动
13.已知NaHSO4在水中的电离方程式为:NaHSO4 Na++H++SO42-。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,洲得溶液的pH为2。下列对该溶液的叙述中,不正确的是 ( )
A.该温度高于25℃
B.由水电离出来的H+的浓度是1.0×l0-10mol·L-1
C.NaHSO4晶体的加入抑制了水的电离
D.该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性
12.对于下列事实的解释错误的是:①蔗糖中加入浓H2SO4后出现发黑现象,说明浓硫酸具有脱水性②浓硝酸的颜色变黄,说明浓硝酸见光易分解③SO2气体通入溴水使溴水褪色,说明SO2具有漂白性。④二氧化硅与碳酸钙高温下反应生成二氧化碳,说明砖酸酸性比碳酸强 ( )
A.①② B.③④ C.只有③ D.只有④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com