
题目列表(包括答案和解析)
13.下列各溶液中,有关成分的物质的量浓度关系正确的是 ( )
A.10mL 0.5mol/L CH3COONa溶液与6mL 1mol/L盐酸混合:
c(Cl-)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C.硫酸氢铵溶液中滴加氢氧化钠至溶液恰好呈中性:
c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
D.pH相等的(NH4)2SO4溶液,(NH4)2Fe (SO4)2溶液和NH4Cl溶液:
c[(NH4)2SO4]<c[(NH4)2Fe (SO4)2]<c(NH4Cl)
12.在25℃时,AgX、AgY、AgZ均难溶于水,且Ksp(AgX) = 1.8×10-10,Ksp(AgY) = 1.0×10-12,Ksp(AgZ) = 8.7×10-17。下列说法(均在25℃)错误的是 ( )
A.三种饱和溶液中溶质的物质的量浓度的大小顺序为c(AgX)>c(AgY)>c(AgZ)
B.若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-)减少
C.若取0.188g的AgY(相对分子质量188)固体放入100 mL水中(忽略溶液体积的变化),则溶液中Y-的物质的量浓度为1.0×10-2mol·L-1
D.往C选项的溶液中加入1 mL 0.1mol·L-1的NaZ溶液,能生成AgZ沉淀
11.著名化学家徐光宪获得2008年度“国家最高科学技术奖”,以表彰他在稀土串级萃取理论方面作出的贡献。稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法不正确的是 ( )
A.铈的冶炼步骤为:用稀土串级萃取法对矿石进行筛选富集;电解熔融CeO2。
B.CeO2溶于氢碘酸的化学方程式可表示为:CeO2+4HI=CeI4+2H2O
C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+=Ce3++Fe3+
D.四种稳定的核素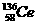 、
、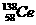 、
、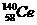 、
、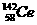 ,它们互称为同位素
,它们互称为同位素
10.向1.00 L 0.3mol·L-1NaOH溶液中缓慢通入CO2气体至溶液增重8.8g。有关该溶液说法正确的是( )
A.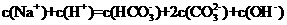
B.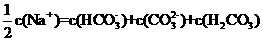
C.
D.溶质为Na2CO3
9. 北京2008奥运会金牌为金镶玉,直径为70mm,厚6mm。某化学兴趣小组对金牌中金属的成分提出猜想:甲认为该金属是由纯金制成;乙认为该金属是由金银合金制成;丙认为该金属是由黄铜(铜锌合金)制成。为了验证他们的猜想,取制造这种金牌的材质粉末少量进行实验,加入下面一种试剂来证明甲、乙、丙猜想的正误,该试剂应是
A.硫酸铜溶液 B.稀硝酸 C.盐酸 D.硝酸银溶液
8. 已知通过乙醇制取氢气有如下两条路线:
a.CH3CH2OH(g)+H2O(g)→4H2(g)+2CO(g) △H= +255.6kJ·mol-1
b.CH3CH2OH(g)+1/2O2(g)→3H2(g)+2CO(g) △H= +13.8kJ·mol-1
则下列说法不正确的是 ( )
A.降低温度,可提高b路线中乙醇的转化率
B.从能量消耗的角度来看,b路线制氢更加有利
C.乙醇可通过淀粉等生物质原料发酵制得,属于可再生资源
D.由a、b知:2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
7. 常温下pH为2的盐酸,下列叙述正确的是 ( )
A.将10mL该溶液稀释至100mL后,pH小于3
B.向该溶液中加入等体积pH为12的氨水恰好完全中和
C.该溶液中由水电离出的c(H+)(水)×c(OH-)(水)==1×10-14
D.该溶液中盐酸电离的c(H+)与水电离出的c(H+)之比为1010:1
6. 四种短周期元素X、Y、Z、W在元素周期表中的相对位置如下表所示,Y、Z质子数
之和为21,下列说法中不正确的是 ( )
|
|
X |
|
Y |
|
Z |
|
W |
|
A.X、Y、Z、W均为非金属元素
B.X、Y、W的氢化物中,Y的氢化物沸点最高
C.Z的阳离子与Y的阴离子电子层结构相同
D.W元素的简单离子半径大于Z元素的简单离子半径
5. 下列化学反应的离子方程式正确的是 ( )
A.石灰石溶于醋酸中:CaCO3+2H+=Ca2++CO2↑+H2O
B.向Ba(OH)2溶液中滴加NH4HSO4溶液至刚好沉淀完全:
Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3·H2O+H2O
C.将少量SO2气体通入足量的NaClO溶液中:SO2+2ClO-+H2O=SO32-+2HClO
D.稀硝酸中加入过量的铁屑:3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O
4.下列化学原理表述正确的是
A.氢硫酸溶液加水稀释,电离程度增大,H+浓度增大;
B.Na2CO3溶液中满足:c(Na+)=2c( CO32-)+2 c( HCO3-)+ 2c (H2CO3)
C.NaHCO3溶液不显中性的原因:HCO3-+H2O CO32-+H3O+
CO32-+H3O+
D.同体积同pH的盐酸和醋酸,与足量的锌反应,盐酸的反应速率快,生成H2的物质的量多;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com