
题目列表(包括答案和解析)
9. 2NO2 2NO+O2在密闭容器中进行,达到平衡状态的标志是 ( )
2NO2 2NO+O2在密闭容器中进行,达到平衡状态的标志是 ( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示反应速率之比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A.①④⑥ B.②③⑤ C.①③④ D.①②③④⑤⑥
11.2L气体(不考虑气体溶解)。下列叙述中不正确的是 ( )
A.阴极上有Cu析出
B.阴极上产生的气体是氢气
C.阳极上产生的气体是氯气和氧气混合气体
D.使溶液恢复到原来状态,需加入适量CuO并通适量HCl气体
8.用惰性电极电解250mLNaCl和CuSO4的混合溶液,经过一段时间后,两电极分别得到
7.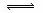 在密闭的容器中进行如下的反应H2(g)+I2(g) 2HI(g),在温度T1和T2时,产物的量和
在密闭的容器中进行如下的反应H2(g)+I2(g) 2HI(g),在温度T1和T2时,产物的量和
时间的关系如下图所示,符合图象的正确的判断是 ( )
 A.T1>T2,△H>0
A.T1>T2,△H>0
B.T1>T2,△H<0
C.T1<T2,△H>0
D.T1<T2,△H<0
6.X、Y、Z三种气体,取X和Y按1:1的物质的量之比混合,放入密闭容器中发生如下
 反应:X+2Y 2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总
反应:X+2Y 2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总
物质的量之比为3:2,则Y的转化率最接近于 ( )
A.33% B.40% C.50% D.65%
5.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4
氧化性更强,无二次污染的绿色处理剂。工业是先制得高铁酸钠,然后在低温下,在高
铁酸钠溶液中:
湿法制备的主要反应方程为: Fe(OH)3+ ClO-+ OH-=== FeO42-+ Cl-+ H2O
干法制备的主要反应为: FeSO4+ Na2O2=== Na2FeO4+ Na2O+ Na2SO4 + O2↑(均未配平)
下列有关说法不正确的是 ( )
A.高铁酸钾中铁显+6价
B.湿法中每生成1 mol Na2FeO4转移3 mol电子
C.干法中每生成1 mol Na2FeO4转移4 mol电子
D.K2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3等,生成的
Fe(OH) 3还能吸附水中的悬浮杂质
4.已知某温度下,在100mL浓度为0.01mol/L的NaHB强电解质溶液中,c(H+)>c(H-),则
下列关系式一定正确的是 ( )
A.溶液的pH=2 B.c(Na+)=0.01mol/L≥c(B2-)
C.c(H+)·c(OH-)=10-14 D.c(Na+)+c(H+)=c(HB-)+c(B2-)+c(OH-)
3.已知:H2 (g)+F2 (g)→2HF(g),△H=-270kJ·mol-1,下列说法正确的是 ( )
A.2L氟化氢气体分解成1L的氢气和1L的氟气吸收270kJ热量
B.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于270kJ
C.在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量
D.1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJ
2.设阿伏伽德罗常数为NA。则下列说法正确的是 ( )
A.常温常压下,6g He所含有的中子数目为2NA
He所含有的中子数目为2NA
B.标准状况下,0.3mol二氧化硫中含有氧原子数为0.3NA
C.常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA
D.常温下,1L 0.1mol/L MgCl2溶液中含Mg2+数为0.2NA
1.下列说法正确的是 ( )
A.可逆反应的特征是正反应速率和逆反应速率相等
B.在其它条件不变时,使用催化剂只能改变反应速率,而不能改变化学平衡状态
C.在其它条件不变时,升高温度可以使平衡向放热反应方向移动
D.在其它条件不变时,增大压强一定会破坏气体反应的平衡状态
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com