
题目列表(包括答案和解析)
7.下列三种有机物是某些药物中的有效成分:
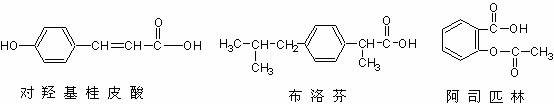
以下说法正确的是
A.三种有机物都能与浓溴水发生反应
B.三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种
C.将等物质的量的三种物质加入氢氧化钠溶液中,阿司匹林消耗氢氧化钠最多
D.使用FeCl3溶液不能鉴别出这三种有机物
可能用到的相对原子质量: H 1 C 12 N 14 O 16 Al 27 Cl 35.5 Fe 56 Cu 64
6.随着科学技术的不断进步,研究物质的手段和途径越来越多,N5+、H3、O4、C60等已被发现。下列有关说法中,正确的是
A.N5+离子中含有36个电子 B.O2与O4属于同位素
C.C60是原子晶体 D.H2与H3属于同素异形体
30.(15分)A是石油化学工业最重要的基础原料,以A为有机原料,无机试剂任选,
按下列途径合成一种常见的医用胶(结构简式为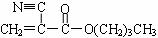 )。
)。
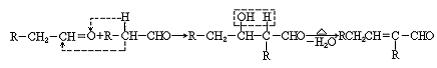 已知 ① 两个醛分子在一定条件下可以发生如下反应:
已知 ① 两个醛分子在一定条件下可以发生如下反应:



②
请根据下列各物质间的转化关系(图中副产物均未写出),回答下列问题:
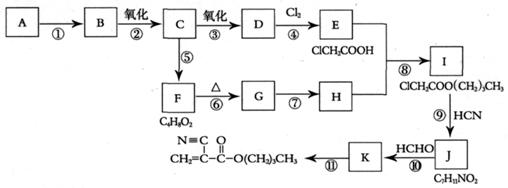
(1)B的结构简式是: ;J的结构简式是: 。
H的名称为: 。
(2)F→G的反应类型是 。(填反应序号)
A.取代反应 B.消去反应 C.加成反应 D.水解反应
(3)G含有官能团的名称为: 。
(4)写出下列反应的化学方程式:
反应⑤: ;
反应⑧: 。
29.(16分)某校化学实验兴趣小组为了探究在实验室制备 Cl2 的过程中有水蒸气和
HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置
(支撑用的铁架台省略),按要求回答问题。
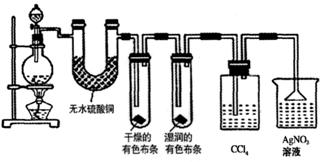
A B C D E F
(1)下列方法中,可制得氯气的正确组合是( )。
(已知酸性条件下,K2Cr2O7、KClO3的氧化性均强于Cl2;酒精灯可以不用)
① MnO2 和浓盐酸混合共热; ②次氯酸钠和浓盐酸混合;
③K2Cr2O7 和浓盐酸混合; ④KClO3 和浓盐酸混合共热;
⑤KMnO4和浓盐酸混合;
A.只有① B.只有①⑤
C.只有①③④⑤ D.全部可以
(2)若用含有 0.2 mol HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2体积 (标准状况下)总是小于1.12 L的原因是 。
(3)①装置B的作用是 ,现象是 。
②装置C和D出现的不同现象说明的问题是 。
③装置E的作用是 。
④写出装置F中发生反应的离子方程式 。
(4)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加
在 之间 ( 填装置字母序号 ),装置中应放入 。
28.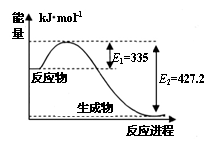 (14分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(14分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)右图是N2和H2反应生成34gNH3过程中能量
变化示意图,则生成1molNH3所放出的热量
为 kJ。
(2)在固定体积的密闭容器中,进行合成氨的反应,
测得压强变化和NH3的含量关系如下表所示,
请完成下列问题:
|
压强(MPa) |
1 |
5 |
10 |
30 |
60 |
100 |
|
NH3% |
2.0 |
9.2 |
16.4 |
35.5 |
53.6 |
69.4 |
①结合实验数据,你得出的结论是: 。
②下列能判断该反应达到化学平衡状态的依据是: (填序号)。
A.v(N2)(正) =3v(H2)(逆) B.容器内N2、H2、NH3的浓度之比为1∶3∶2
C.混合气体的密度保持不变 D.NH3的生成速率等于NH3的分解速率
E.容器内压强保持恒定 F.混合气体的平均相对分子质量保持不变
(3)若有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1 mol N2和3 mol H2,
在一定条件下到达平衡时放出热量为Q1 kJ;在相同的条件下,向乙容器中加入
2 mol NH3达到平衡后吸收热量为Q2 kJ,已知Q2=3Q1。则甲容器中H2的转化率
为 。
(4)最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实现氨的电
解法合成,大大提高了氮气和氢气的转化率。总反应式为:N2+3H2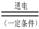 2NH3。则在电解法合成氨的过程中,应将H2不断地通入 极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为
。
2NH3。则在电解法合成氨的过程中,应将H2不断地通入 极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为
。
27.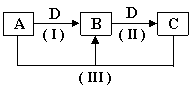 (15分)A、B、C、D是中学化学的常见
(15分)A、B、C、D是中学化学的常见
物质,其中A、B、C均含有同一种元素。
在一定条件下相互转化的关系如右图所示
(部分反应中的H2O已略去)。请回答
下列问题: (1)若D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不
能得到B,则B的化学式可能为: (只写一种)。 (2)若A是一种碱性气体,常用作制冷剂,B和D为空气的主要成分,则反应(II)
的化学方程式为: 。 (3)若D为氯碱工业的主要产品,B有两性,则反应(Ⅱ)的离子方程式是 。 (4)若D为酸或酸性气体,则A、C可以是 (请按顺序写出任意一组
符合要求的物质的化学式)。 (5)若C是一种温室气体,D是空气的主要成分之一,1mol黑色固体A完全燃烧
放出393.5kJ热量,1molB气体完全燃烧放出283.0kJ热量,则A→B反应的
热化学方程式为: 。
13.将含有0.40molCu(NO3)2和0.40molKCl的水溶液1L,用惰性电极电解一段时间后,
在一个电极上析出0.30molCu,则此时在另一极上收集到的气体在标准状况下的体积为
A.3.36L B.6.72L C.小于5.60L D.大于5.60L
12.下列说法错误的是
A.室温下:PH之和为14的氢氧化钡与盐酸等体积混合,溶液一定呈中性
B.在[(NH4)2 Fe(SO4)2·6H2O]的水溶液中:c(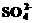 )>c(
)>c(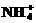 )>c(Fe2+)>c(H+)>c(OH-)
)>c(Fe2+)>c(H+)>c(OH-)
C.在浓度为0.1mol/L NaHCO3的溶液中:c(Na+)+c
(H+)=c (OH-)+2c
(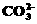 )+c (
)+c (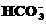 )
)
D.室温下:pH之和为14的氨水与硝酸等体积混合,溶液一定呈中性
11.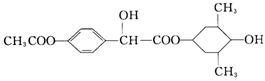 德国医学家通过大量的临床实验证明
德国医学家通过大量的临床实验证明
环扁桃酯可治疗心血管疾病,该物质
的结构简式如右,下列说法正确的是
A.该物质既属于芳香族化合物,又属于芳香烃
B.该物质能发生取代反应和水解反应
C.该物质遇FeCl3溶液显紫色,与苯酚互为同系物
D.1mol该物质水解最多消耗5molNaOH
10.下列各组离子,在指定的环境中一定能大量共存的是
A.在c(H+)/c(OH-)=1×1012的溶液中:I-、Cl-、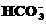 、Na+
、Na+
B.在能使pH试纸变红色的溶液中:Na+、S2-、 、
、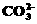
C.由水电离出的c(H+)=1×10-12mol·L-1的溶液中:K+、Cl-、 、Na+
、Na+
D.在加入铝粉能产生H2的溶液中: 、Fe2+、
、Fe2+、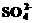 、Cl-、
、Cl-、
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com