
题目列表(包括答案和解析)
14.在密闭容器中充入CO和CO2的混合气体,其密度是相同条件下氦气密度的8倍,这时测得容器内压强为P1,若控制容器的体积不变,加入足量的过氧化钠,并不断用电火花点燃至完全反应,恢复到开始的温度,再次测得容器内的压强为P2,则P1和P2关系是 ( )
A. P1=P2 B. P1=4P2 C. P1=2P2 D. P1=8P2
13.1mol过氧化钠与1.2 mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是 ( )
A.Na2CO3 B.Na2O2 Na2CO3
C.NaOH Na2CO3 D.Na2O2 NaOH Na3CO3
12.钙和钠相似,也能形成含O22-离子的过氧化物,下列叙述不正确的是 ( )
A.过氧化钙的化学式是CaO2
B.1 mol过氧化钙或过氧化钠跟足量的水反应都生成1mol氧气
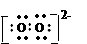
C.O22-离子的电子式为
D.过氧化钙在未开放的花朵旁边,可以延缓花朵的开放.
11.按如图所示实验装置进行钠跟水反应的实验,据此判断下列说法正确的是 ( )
A.
 打开右端胶塞,将一小块金属钠加入到煤油中,反应
打开右端胶塞,将一小块金属钠加入到煤油中,反应
 前片刻,钠的 位置应在a处
前片刻,钠的 位置应在a处
B. 开始反应后,能观察到的实验现象是钠在b处液面以
下的水中反应
C.反应一段时间后,左端液面上升,进入长颈漏斗,a
处有无色气体产生
D.若用苯或酒精来代替煤油,可观察到相同的实验现象
10.设计下列实验方案鉴别Na2CO3和NaHCO3两种白色粉末,不能达到预期目的的是( )
A.分别向等量的白色粉末中加等体积、等浓度的稀盐酸,比较生成气体的快慢
B.分别向等量的白色粉末中加等体积适量的水,比较固体溶解量的多少
C.分别将等量的白色粉末配成溶液,然后加入澄清石灰水,比较是否有沉淀生成
D.分别将等量的白色粉末用右图装置进行实验,比较澄清石灰水是否变混浊
9.下列表示工业生产主要反应的化学方程式正确的是 ( )
A.煅烧黄铁矿:2FeS2 + 5O2
 2FeO + 4SO2
2FeO + 4SO2
B.高炉炼铁:Fe2O3
+ 3C  2Fe + 3CO
2Fe + 3CO
|
D.工业法合成盐酸:H2 + Cl2====2HCl
8.已知:H+(aq) + OH-(aq) =H2O(l) ;△H=-57.3 kJ/mol。对于下列反应:
①HCl(aq) + NH3·H2O(aq)= NH4Cl(aq) + H2O(l) ;△H=-a kJ/mol
②HCl(aq) + NaOH(s) = NaCl(aq) + H2O(l) ;△H=-b kJ/mol
③HNO3(aq) + KOH(aq) = KNO3(aq) + H2O(l) ;△H=-c kJ/mol
则a、b、c三者的大小关系为 ( )
A.a>b>c B.b>c>a C.a=b=c D.无法比较
7.化学平衡常数(K)、电离常数(Ka)、溶度积常数(KSP)是判断物质性质或变化的重要的常数。下列关于这些常数的说法中,正确的是 ( )
A.化学平衡常数的大小与温度、浓度、压强、催化剂有关
B.当温度升高时,弱酸的电离常数Ka变小
C.KSP(AgCl)>KSP(AgI)由此可以判断AgCl(s)+I-=AgI(s)+Cl-能够发生
D.Ka(HCN)<Ka(CH3COOH)说明相同物质的量浓度时,氢氰酸的酸性比醋酸强
6.下列各组物质相互混合反应,既有气体生成最终又有沉淀生成的是 ( )
①金属钠投入FeCl3溶液中 ②过量的NaOH溶液和明矾溶液
③Na2S2O3溶液与稀硫酸 ④ Na2O2投入FeCl2溶液中
⑤浓硫酸铵溶液加入到浓氢氧化钠中 ⑥Al2(SO4)3与Na2SiO3溶液
A.①②④ B.③④⑤ C.①③④⑥ D.①③④
5.下列排列顺序正确的是 ( )
①热稳定性:H2O>HF>H2S ②还原性:HI>HBr>HC1
③熔沸点:Na>Mg>A1 ④结合H+能力:OH->CH3COO->Cl-
A.①③ B.②③ C.①④ D.②④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com