
题目列表(包括答案和解析)
5.工业上制备纯硅的热化学方程式为SiCl4(g)+2H2(g)
 Si(s)+4HCl(g);
Si(s)+4HCl(g);
⊿H=+Q kJ/mol(Q>0),则该反应的适宜条件是
A.高温高压 B.低温低压
C.高温低压 D.低温高压
4.MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如右图所示。下列叙述中正确的是
A.MOH和ROH都是强碱
B.稀释前,c(ROH)=10c(MOH)
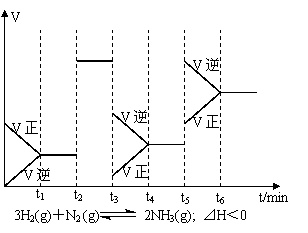 C.常温下pH之和为14的醋酸和ROH溶液等体积混合,所得溶液呈碱性
C.常温下pH之和为14的醋酸和ROH溶液等体积混合,所得溶液呈碱性
D.在x点,c(M+)=c(R+)
3.下列离子方程式正确的是
A.等物质的量的硫酸氢钠溶液跟氢氧化钡溶液混合:
H++SO42-+Ba2++OH-=BaSO4↓+H2O
B. 将标准状况下112 mL氯气通入10 mL浓度为1 mol·L-1的溴化亚铁溶液中:
2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2
C. 用NaOH吸收少量H2S: OH-+H2S=HS-+H2O
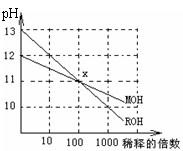 D. 向碳酸氢镁溶液中加入过量的澄清石灰水:
D. 向碳酸氢镁溶液中加入过量的澄清石灰水:
Mg2++2HCO3-+Ca2++2OH-=MgCO3↓+CaCO3↓+2H2O
2.下列各组离子在溶液中可以大量共存,加入足量FeBr2晶体时,只有一种离子浓度明显减少的是
A.K+、OH-、CO32- B.Na+、Cl-、Ag+ C.K+、SO42-、S2- D.H+、Cu2+、NO3-
1.在m A(g) + n B(g)  p C(g) + q D(g)的反应中,(m、n、p、q为各物质的化学计量数),经5min达到平衡,测得:A增加3 mol·L-1,B增加1 mol·L-1,C减少2 mol·L-1,此时若给体系加压,平衡不移动,则m :n
:p :q为
p C(g) + q D(g)的反应中,(m、n、p、q为各物质的化学计量数),经5min达到平衡,测得:A增加3 mol·L-1,B增加1 mol·L-1,C减少2 mol·L-1,此时若给体系加压,平衡不移动,则m :n
:p :q为
A.2 :3 :2 : 3 B.2 :2 :3 : 3 C.3 :1 :2 : 2 D.3 :1 :2 : 3
22.(15分)
纯铁在冷的浓硫酸中能发生钝化。某兴趣小组同学发现将一定量的纯铁与浓硫酸加热时,铁完全溶解,得到溶液A,并产生大量气体B。实验室现有下列试剂: 0 .01 mol/L 酸性KMnO4溶液、0.1
mol/L KI溶液、3%H2O2溶液、淀粉溶液、蒸馏水。请你协助他们探究所得溶液和气体的成分,并将有关实验操作、预期现象和结论填入下列表格中。
.01 mol/L 酸性KMnO4溶液、0.1
mol/L KI溶液、3%H2O2溶液、淀粉溶液、蒸馏水。请你协助他们探究所得溶液和气体的成分,并将有关实验操作、预期现象和结论填入下列表格中。
[提出猜想]
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
Ⅱ.所得气体中可能含有 中的一种或两种。
Ⅲ.任意写出一个铁与浓硫酸加热时,可能发生的有关反应方程式
[实验探究]
|
|
实验操作 |
预期现象 |
结 论 |
|
验证猜想Ⅰ |
步骤①:取少量溶液A,滴入0.01 mol/L 酸性KMnO4溶液 |
|
|
|
步骤②: |
|
含有Fe3+ |
|
|
验证猜想Ⅱ |
将所得气体B通入如下图装置 |
|
含有两种气体 |
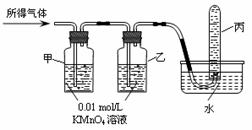 [问题讨论]
[问题讨论]
有同学提出,若另外选用KSCN溶液,则
仅利用KSCN和H2O2两种溶液即可完成
猜想Ⅰ的所有探究,请对该观点进行评价:
。
21. 科学家预言,燃料电池将是21世纪获得电力的重要途径,美国已计划将甲醇燃料电池用于军事目的。一种甲醇(CH3OH )燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。回答下列问题:(11分)
)燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。回答下列问题:(11分)
(1)这种电极放电时发生的总反应是______________________________________。
(2)此电极的正极发生的电极反应式是__________________________;
负极发生的电极反应式是_______________________________。
(3)电解液中的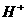 离子向_________极(正极或负极)移动;通入正极的气体是________.
离子向_________极(正极或负极)移动;通入正极的气体是________.
20. 写出下列反应的热化学方程式:(6分)
(1) 32.5g锌在氧气中完全燃烧生成氧化锌固体,放出175KJ的热量。
。
(2) 氢气与碘蒸气反应,生成1molHI气体时,吸收25.9KJ的热量;
。
19. 甲、乙两个容器中,分别加入0.1mol/L NaCl溶液与0.1mol/L AgNO3溶液后,以Pt为电极进行电解时,
甲、乙两个容器中,分别加入0.1mol/L NaCl溶液与0.1mol/L AgNO3溶液后,以Pt为电极进行电解时, (14分)
(14分)
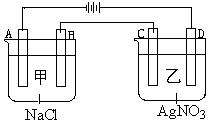
(1)写出电极名称和电极反应式:
A
B
C
D 
(2)在A、D电极上生成的气体物质的量之比为:_____________
18. 已知在29 8K时的热化学反应方程式:(3分)
8K时的热化学反应方程式:(3分)
C(s,石墨)+O2(g)=CO2(g); △H1=-393.5kJ/mol,
2CO(g)+O2(g)=2CO2(g); △H2=-566.0kJ/mol。
则298K时,反应 C(s,石墨)+ 1/2 O2(g) = CO (g)的△H是______________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com