
题目列表(包括答案和解析)
4.下列化学用语正确的是
A.次氯酸的电子式: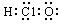 B.CH4Si的结构式:
B.CH4Si的结构式: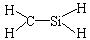
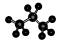 C.HCN分子的结构式:H-C≡N D.丙烷分子的比例模型:
C.HCN分子的结构式:H-C≡N D.丙烷分子的比例模型:
3、对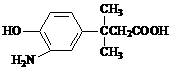 的表述不正确的是:
的表述不正确的是:
A.能和盐酸、氢氧化钠反应 B.1mol能与3molBr2在苯环上发生取代反应
C.使FeCl3溶液显紫色 D.能与NaHCO3反应产生CO2
2.下列关于化工生产原理的叙述中,均符合目前工业生产实际的是( )
A.氯碱工业中,电解槽的阳极区产生NaOH
B.氯气和氢气混合在光照条件下生成氯化氢,用水吸收得到盐酸
C.合成氨工业中,由于氨易液化,N2、H2循环使用,所以总体上氨的产率很高
D.二氧化硫在接触室被氧化成三氧化硫,三氧化硫在吸收塔内被水吸收制成浓硫酸
1、下列说法不正确的是 ( )
A.倡导低碳环保理念,可推广使用环保石头纸(主要成分是碳酸钙)
B.在鸡蛋清溶液中滴加饱和Na2SO4溶液或CuSO4溶液,都可使蛋白质盐析
C.生吃新鲜蔬菜比熟吃蔬菜更有利于获取维生素C
D.网状结构的聚丙烯酸钠是一种高分子树脂,其吸水性高于相同质量的医用脱脂棉
26.(6分)
(1)a粒子的原子结构示意图
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为 > 用化学式表示)
(3)d溶于水的电离方程式
(4) g粒子所构成的晶体类型属
(5) c粒子是 ,f粒子是 (用化学式表示)
27. (8分)
(1)A B C D
(2)写出E+F→H+I的离子方程式
(3)写出G+I→H+D+E的化学反应方程式
28. (16分)
(1)P和Cl2反应生成PCl3的热化学方程式是
;
(2)PCl5分解成PCl3和Cl2的热化学方程式是
;
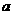 1等于
;
1等于
;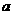 2
2
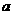 1(填“大于”、“小于”或“等于”);
1(填“大于”、“小于”或“等于”);
(3)原因是 ;
(4)△H 3= ,△H 4 △H 3(填“大于”、“小于”或“等于”)。
(5) 。
29. (8分)(1) mL.
(2) mL. ks*5u
(3)V1的取值为 (填范围)
(4)V2的取值为 (填范围)
30. (12分)
(1)步骤①所加入的A的化学式为________;加入A的作用是
;沉淀物B是________(填化学式).
(2)A应接直流电源的________极.
B电极上发生的电极反应式为____________________________.
(3)实验操作属必要的是________(填字母,下同),属不必要的是________.
(4)加入石蕊试液,观察到的现象是_________________________.
(5)铜的相对原子质量的计算式为________.
(6)步骤②的变化中,从能量转化的角度看是_______能转化为______能与______能.
30.(12分)已知在pH为4-5的溶液中,Cu2+几乎不水解,而Fe3+几乎完全水解.某学生拟用电解CuSO4溶液的方法测定铜的相对原子质量.其实验流程如下图所示:
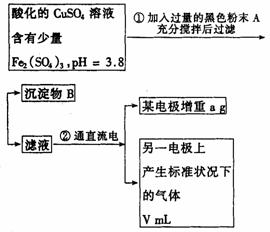
试回答下列问题:
(1)步骤①所加入的A的化学式为________;加入A的作用是__________________
_______________________;沉淀物B是________(填化学式).
(2)步骤②中所用部分仪器如图所示:则A、应接直流电源的________极.B电极上发生的电极反应式为____________________________.
(3)下列实验操作属必要的是________(填字母,下同),属不必要的是________.
A.称量电解前电极的质量
B.电解后电极在烘干前,必须用蒸馏水冲洗
C.剩下电解后电极上的铜,并清洗、称量
D.电极在烘干称重的操作中必须按:烘干→称重→再烘干→再称重进行两次
E.在空气中烘干电极,必须采用低温烘干法
(4)电解后向溶液中加入石蕊试液,观察到的现象是_________________________.
(5)铜的相对原子质量的计算式为________.
(6)步骤②的变化中,从能量转化的角度看是_______能转化为______能与______能.
|
|
命题、审核:姚启文
29.(8分)常温下,有pH=12的NaOH溶液100mL,若将其pH变为11(该溶液体积可直接相加,计算结果保留到小数点后两位。)
(1)若用pH=10的NaOH溶液,应加入 mL.
(2)若用pH=2的盐酸,应加入 mL.
(3)若用0.01mol/L的CH3COOH溶液V1 mL,则V1的取值为 (填范围)
(4)若用pH=2的任意一元酸HR溶液V2 mL ,则V2的取值为 (填范围)
28.(16分)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
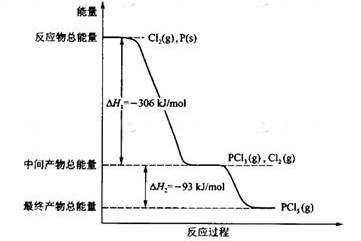
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是
;
(2)PCl5分解成PCl3和Cl2的热化学方程式是
;
上述分解反应是一个可逆反应。温度T1时,在密闭容器中加入0.80mol PCl5,反应达平衡时PCl5还剩0.60
mol,其分解率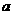 1等于
;若反应温度由T1升高到T2,平衡时PCl5的分解率为
1等于
;若反应温度由T1升高到T2,平衡时PCl5的分解率为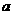 2,
2,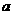 2
2
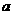 1(填“大于”、“小于”或“等于”);
1(填“大于”、“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,现将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是 ;
(4)P和Cl2分两步反应生成1 mol PCl5的△H 3= ,P和Cl2一步反应生成1 mol PCl5的△H 4 △H 3(填“大于”、“小于”或“等于”)。
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是ks*5u
。
27.(8分)A、B、C、D为四种单质,常温时,A、B是气体,C、D是固体。E、F、G、H、I为五种化合物,F不溶水,E为气体且极易溶水成为无色溶液,G溶水得黄棕色溶液。这九种物质间反应的转化关系如图所示
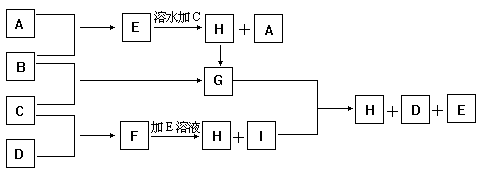
(1)写出四种单质的化学式
A_________ B__________ C______ D________
(2)写出E+F→H+I的离子方程式
(3)写出G+I→H+D+E的化学反应方程式
26.(6分) a、b、c、d、e、f、g为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
|
微粒代码 |
a |
b |
c |
d |
e |
F |
g |
|
原子核数 |
单核 |
单核 |
双核 |
多核 |
单核 |
多核 |
多核 |
|
带电荷数(单位电荷) |
0 |
1+ |
1 |
0 |
2+ |
1+ |
0 |
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子极性分子;c与f可形成两个共价型g分子。
试写出:(1)a粒子的原子结构示意图
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为 > 用化学式表示)
(3)d溶于水的电离方程式
(4) g粒子所构成的晶体类型属 ks*5u
(5) c粒子是 ,f粒子是 (用化学式表示)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com