
题目列表(包括答案和解析)
24、(12分)有机物A是一种含溴的酯,分子式为C6H9O2Br。已知A有如下的转化关系:
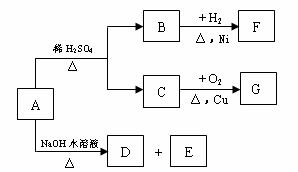
其中B、C含相同数目的碳原子,B既能使溴水褪色,又能与Na2CO3溶液反应放出CO2气体,G能发生银镜反应,经测定E是一种二元醇,且E分子中含有一个甲基。
(1)写出D的结构简式 。
(2)写出B中官能团的名称 。
(3)写出C催化氧化的化学方程式: 。
(4)写出F属于酯类的同分异构体的结构简式
; 。
(5)写出A在NaOH水溶液中水解的化学方程式: ___________________________。
23、(10分)A、B、C、D为四种易溶水的常见物质,它们分别由NH4+、Al3+、Ba2+、Na+,阴离子:SO42-、OH-、HCO3-、Cl-两两组合而成,且每种离子只出现一次。将A、B、C、D四种物质的水溶液两两混合(实验是可加热),实验现象如下:①B溶液和C溶液混合时产生白色沉淀,且白色沉淀不溶于盐酸。
②A溶液和D溶液混合时产生白色沉淀,同时有气体生成。
③A溶液和B溶液混合时产生白色沉淀,同时有气体生成。
(1)据此推断下列物质的化学式:A ,B ,C ,D 。
(2) A与足量的B反应的离子方程式为
22、(14分)A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系知下图所示。
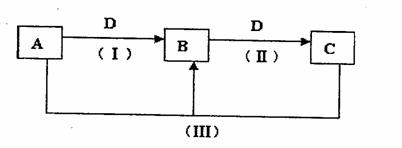
请回答下列问题:
(1)若D为用量最大、用途最广的金属单质,加热蒸干B的溶液没有得到B的盐,则B的化学式可能为 。(写出一种即可)
(2)若通常情况下A、B、C、D都是气体,且B和D为空气的主要成分,则A的空间构型为 ,B的结构式为 。
(3)若D为氯碱工业的重要产品,反应(Ⅲ)的离子方程式为 。
(4)若A、B、C的溶液均显碱性,c为焙制糕点的发酵粉的主要成分之一,也可作为医疗上治疗胃酸过多症的药剂。
①25℃时,pH均为10的A、B两溶液中,由水电离出的氢氧根离子浓度之比为
②25℃时,0.1mol·L-1的A、B、C三种溶液,分别用水稀释不同的倍数后 ,溶液的pH相同,则稀释后溶液的物质的量浓度最大的是
溶液(填溶质的化学式)。
,溶液的pH相同,则稀释后溶液的物质的量浓度最大的是
溶液(填溶质的化学式)。
③将等物质的量的B和C溶于水形成混合溶液,溶液中各种离子浓度由大到小顺序为 。
21、(10分)有A、B、C三种常见的短周期元素,它们的原子序数逐渐增大,B元素原子最外层电子数是C元素原子最外层电子数的一半,A元素最外层电子数比B多一个。甲、乙、丙是3种含氧酸的钠盐,甲中含B元素,乙中含C元素,丙中含A元素,甲、丙溶液pH >7,乙溶液pH <7;丁 为气体,戊为淡黄色固体。甲、乙、丙、丁、戊、己六种物质之间的相互反应关系如下图
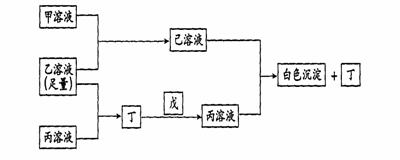
请回答
(1)写出A与C形成化合物的电子式________ ,A与B形成化合物的化学式为
(2)用化学用语解释甲溶液呈碱性的原因_______________;
(3)写出有关反应的离子方程式
①乙溶液+丙溶液→丁________________________________________________;
②己溶液+丙溶液→丁________________________________________________。
20.取9.20 g铜和镁的合金完全溶于400 mL某浓度的浓硝酸中,若反应中硝酸被还原只产生NO2气体,在反应后的溶液中,加入664 mL 5.00 mol·L-1的氢氧化钠溶液,恰好反应且生成沉淀的质量为17.02 g,则原浓硝酸的溶质的物质的量浓度为 ( )
A.8.30 mol·L-1 B.9.45 mol·L-1 C.9.20 mol·L-1 D.10.45 mol·L-1
第Ⅱ卷(非选择题,共60分)
19.氨气跟二氧化氮在一定条件下反应可生成氮气和水,若反应使用的14NH3和15NO2,则所得氮气的摩尔质量(g/mol)约为( )
A、28.86 B、29.00 C、29.14 D、29.60
18.某有机化合物A的相对分子质量大于100,小于130。经分析得知,其中碳和氢的质量分数之和为46.66%,其余为氧,则该化合物分子中最多含碳氧双键的个数为 ( A )
A.1 B.2 C.3 D.4
17、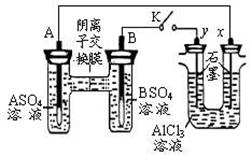 某同学按右图所示的装置进行试验。A、B
为两种常见金属,它们的硫酸盐可溶于水。当 K 闭合时,在交换膜处
SO42一从右向左移动。下列分析错误的是( )
某同学按右图所示的装置进行试验。A、B
为两种常见金属,它们的硫酸盐可溶于水。当 K 闭合时,在交换膜处
SO42一从右向左移动。下列分析错误的是( )
A.金属活动性A强于B
B.B 的电极反应:B-2e一= B2+
C.x电极上有 H2 产生,发生还原反应
D.反应初期,x 电极周围出现白色沉淀
16、下列关于电解质溶液的判断正确的是
A.相同物质的量浓度的下列溶液中:①NH4Al(SO4)2、②NH4Cl、
③CH3COONH4、④NH3·H2O,c(NH4+) 由大到小的顺序是:①>②>③>④
B.物质的量浓度相等的 H2S 和 NaHS 混合溶液中:
c (Na+) +c(H+) = c (S2―) +c (HS―)+c (OH―)
C.HF比HCN易电离,则NaF溶液的 pH 一定比 NaCN 溶液小
D.常温下pH=6的酸性溶液中,不可能存在NH3·H2O分子
15、可逆反应aA(?)+2 B(g)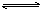 2C(g)+D(g),其中a为正整数。反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是( )
2C(g)+D(g),其中a为正整数。反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是( )
A.达到平衡后,加入催化剂则C%增大 B.达到平衡后,若升高温度,平衡向右移动
C.a可以为任意的正整数 D.达平衡后,增加A的量,有利于平衡向右移动
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com