
题目列表(包括答案和解析)
9.在下列条件下,各离子组一定能大量共存的是 ( )
A.强碱性溶液中:K+、Al3+、Cl-、SO42-
B.室温下,pH=0的溶液中: Na+、Fe3+、NO3-、SO42-
C.含有1 mol·L-1 Fe3+的溶液中:K+、Mg2+、I-、NO3-
D.由水电离的c(H+)=1×10-14mol•L-1的溶液中:K+、NH4+、Cl-、SO42-
8.短周期元素A、B,若A离子与B离子电子层结构相同,且A离子半径大于B离子半径,则下列说法一定正确的是 ( )
A.原子半径A<B B.电负性A<B
C.元素A、B不同周期 D.A原子序数小于B原子序数
7. 三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:
3NF3 + 5H2O = 2NO + HNO3 + 9HF下列有关该反应的说法正确的是 ( )
A.NF3是氧化剂,H2O是还原剂
B.还原剂和氧化剂的物质的量之比是2:1
C.若生成0.2mol HNO3,则转移0.2mol电子
D. NF3在潮湿的空气中泄漏会产生红棕色气体
6.下列各组物质在一定条件下都能跟水反应的是 ( )
① 铁、木炭、纤维素 ② 镁、硫磺、乙酸乙酯 ③ 淀粉、蛋白质、葡萄糖
④ 氯气、脂肪、乙烯 ⑤ 硫化铝、纯碱、蔗糖
A.②③ B.①④ C.①④⑤ D.①③④⑤
5. 下列反应的离子方程式书写正确的是 ( )
A.将1-2mL氯化铁饱和溶液滴入到20mL沸水中:Fe3+ + 3H2O = Fe(OH)3(胶体) + 3H+
B.FeSO4溶液中加入H2O2:2Fe2++H2O2+2H+=2Fe3++2H2O
C.向Ca(HCO3)2溶液中加入少量的NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
D.向NaHSO4溶液中滴加Ba(OH)2至SO42-沉淀完全:2H+ + SO42- + Ba2+ + 2OH- = BaSO4↓+2H2O
4.下列各组关于强电解质、弱电解质、非电解质的归类正确的 ( )
|
|
A |
B |
C |
D |
|
强电解质 |
Fe |
NaCl |
BaSO4 |
HNO3 |
|
弱电解质 |
CH3COOH |
NH3 |
H2CO3 |
Fe(OH)3 |
|
非电解质 |
蔗糖 |
CaCO3 |
C2H5OH |
H2O |
3.“稀土”是我国宝贵的战略资源,国家即将控制其出口。 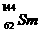 与
与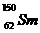 是稀土元素,下列有关说法不正确的是 ( )
是稀土元素,下列有关说法不正确的是 ( )
A. 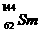 与
与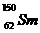 互为同位素
互为同位素
B.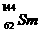 在元素周期表中位于第三周期第ⅢB族
在元素周期表中位于第三周期第ⅢB族
C. 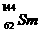 与
与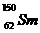 是不同的核素
是不同的核素
D. 据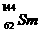 与
与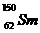 的质量数可以确定Sm元素的相对原子质量为147
的质量数可以确定Sm元素的相对原子质量为147
2.设NA为阿伏加德罗常数的值,下列说法中正确的是 ( )
A.1mol乙基中含有的电子数为17NA
B.标准状况下,22.4L三氯甲烷中共价键数目为4NA
C.1mol硫粉与足量的Cu粉共热,转移的电子数为1NA
D.7.8gNa2O2晶体中含有阴阳离子总数为0.4NA
1.下列有关化学用语书写正确的是 ( )
①蔗糖的最简式是CH2O ②次氯酸的结构式:H-Cl-O
③苯甲醇的结构简式: -CH2OH ④甲烷分子的比例模型:
-CH2OH ④甲烷分子的比例模型: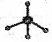
⑤S2-的电子排布图为:1s22s22p63s23p6 ⑥原子核内有10个中子的氧离子: 2-
2-
A.②③⑥ B.③⑥ C.①③⑤⑥ D.①②③④⑤⑥
25.(14分)小苏打(NaHCO3)试样中含有碳酸钠晶体(Na 2CO3·10H2O),为测定试样中小苏打的质量分数w(NaHCO3),实验小组同学设计了如下装置进行实验。
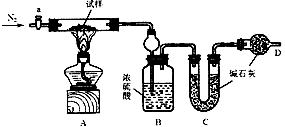
实验过程
(1)、按图组装仪器,检查装置的气密性;
(2)、将试样m1g放入硬质玻璃管中,装置B、C、D中药品如图,已知加药品后装置B的质量为m2g、装置C的质量为m3g;
(3)、关闭活塞a,点燃酒精灯加热试样,直到B装置中无气泡冒出后,打开活塞a向装置中通入N2,一段时间后,撤掉酒精灯,关闭活塞a;
(4)、称得装置B的质量为m4g、装置C的质量为m5g。
请回答以下问题(装置中原有空气对实验的影响忽略不计):
(1) 装置A中发生反应的化学方程式为
(2) 装置D的作用为
(3) 实验过程中通入N2的目的为
(4) 用下列各项所提供的数据能计算出w(NaHCO3)的是( ) (填选项字母)
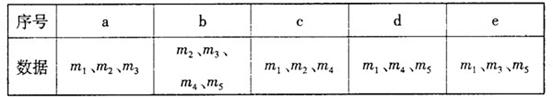
(5)实验结束后发现装置A中硬质玻璃管右端有水珠,你认为利用实验中所提供的数据还能否得到准确的w(NaHCO3),若能,则w(NaHCO3)的计算式为: 。若不能,此问不作答。
2010-2011学年高三年级上学期期末考试
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com