
题目列表(包括答案和解析)
2.下列有关物质用途的说法中,错误的是
A.钠钾合金在常温下呈液态,可以作为原子反应堆的导热剂
B.日常生活中无水乙醇常用于杀菌消毒
C.加碘盐是在食盐中加入一定量的碘酸钾,可预防甲状腺肿大
D.苯酚的稀溶液可直接用作防腐剂和消毒剂
1.人类将在未来几十年内逐渐由“ 碳素燃料文明时代”过渡至“太阳能文明时代”(包括风能、生物质能等太阳能的转换形态)。下列不符合这一主题的是
碳素燃料文明时代”过渡至“太阳能文明时代”(包括风能、生物质能等太阳能的转换形态)。下列不符合这一主题的是
A.减少一次性用品的使用
B.利用太阳能蒸馏海水进行海水的淡化
C.避开公共交通的拥挤,倡导自驾出行
D.海水和淡水交汇处安装半透膜,利用水中电解质浓度的差异进行发电
28、在T℃条件下,向1L固定体积的密闭容器M中加入2
mol X和1 mol Y,发生如下反应:
2X(g) + Y(g)  a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)
a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)
当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)、 化学计量数a的值为 。
(2)、下列说法中能说明该反应达到了化学平衡状态的是 。
A:容器内压强一定 B:容器内气体的密度一定
C:容器内Z分子数一定 D:容器内气体的质量一定
(3)、维持温度不变,若起始时向该容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是 (稀有气体不参与反应)。
A.2 mol X、1mol Y、1mol Ar B.a mol Z、1mol W
C.1 molX、0.5mol Y、0.5a mol Z、0.5 mol W D.2 mol X、1mol Y、1mol Z
(4)、维持温度不变,若起始时向容器中加入4mol X和6 mol Y,若达平衡时容器内的压强减小了10%,则反应中放出的热量为 kJ。
(5)、维持T℃条件不变,若在一个和原容器体积相等的恒压容器N 中,加入2 mol X和1 mol Y发生如上反应并达平衡,则 (选填M或N)容器中的反应先达到平衡状态,容器中X的质量分数M N(选填>、<、=符号)。
(6)已知:该反应的平衡常数随温度的变化如下表:
|
温度/℃ |
200 |
250 |
300 |
350 |
|
平衡常数K |
9.94 |
5.2 |
1 |
0.5 |
试回答下列问题
若在某温度下,2 mol X和1 mol Y在该容器中反应达平衡, X的平衡转化率为50%,则该温度为 ℃。
27.下图为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去,已知乙醇的沸点为78.5℃),请根据要求完成下列问题(仪器装置可任意选用,必要时可重复选择,a、b为旋钮)。


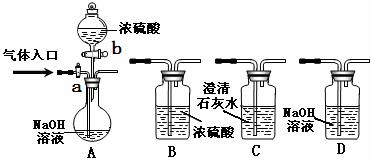

(1)若A中气体入口通入CO和CO2的混合气体,E内放置CuO,欲得到纯净干燥的CO,并验证其还原性及氧化产物,所选装置的连接顺序为________ ___ (填写装置代号)。能验证CO氧化产物的实验现象是___________________ ____。
(2)完成(1)实验后,将A中a旋钮关闭,并在E内放置Na2O2,按A→E→D→B→H装置顺序,制取纯净干燥的O2,并用O2氧化乙醇。
①为获得氧气,关闭a旋钮后,首先需进行的操作是 。
②为得到平稳的乙醇蒸气流,提高反应效率,可采取的措施是(用文字简述) _ __;m中发生反应的化学方程式是___________________ ____并指出生成的有机物中碳原子的杂化轨道类型 资
26.下列转化关系图中,A、B、C、D、E常温下为气体,B、E、F、K为单质,其中F为黑色固体;C、D均能使澄清的石灰水变混浊,D、E均能使品红溶液褪色;I是一种红棕色固体氧化物。
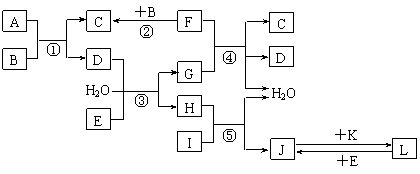

请回答下列问题:
(1)C的电子式为 。
(2)检验溶液L中金属阳离子的方法是 。
(3)反应③的离子方程式为 。
(4)F与G的浓溶液反应的化学方程式为 _。
(5)气体A的密度为2.68g·L-1(标准状况),通过计算、推理,可确定A的分子式为 。
25.今有A、B、C、D、E、F五种元素,A原子核中只含一个质子;B最外层电子数是次外层电子数的2倍;C元素的正三价离子的3d能级为半充满; E原子的M层和N层分别比D原子的M层和N层多5个电子;F原子的N层只有一个电子,而M层为全充满。
(1)写出B的基态原子的价电子轨道表示式
(2)C的元素符号 ,其基态原子的电子排布式为
(3)若E与C能反应生成离子化合物CE3,则D的原子结构示意图为 ;
A和B按原子个数比为1:1组成的相对分子质量为78的芳香烃与E的单质反应的化学方程式为
(4)向元素F的硫酸盐中逐滴加入氨水至过量,写出该过程涉及反应的离子方程式:
24.根据下列热化学方程式( )
(1)C(s) + O2(g) === CO2(g) ;△H1=-393.5 kJ/mol
(2)H2(g) + 1/2O2(g) === H2O(l) ;△H2=-285.8 kJ/mol
(3)CH3COOH(l) + 2O2(g) === 2CO2 (g) + 2H2O(l);△H3=-870.3kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为
A.△H=244.1kJ/mol B.△H=-488.3kJ/mol
C.△H=-996.6kJ/mol D.△H=996.6kJ/mol
第Ⅱ卷 (非选择题 共52分)
23. 巴豆酸的结构简式为CH3-CH=CH-COOH,现有①氯化氢 ②溴水 ③纯碱溶液
④2-丙醇 ⑤酸化的高锰酸钾溶液。试根据其结构特点判断在一定条件下能与巴豆酸反
应的物质组合是( )
A.②④⑤ B.①③④ C.①②③④ D.①②③④⑤
22.己知维生素A的结构简式可写为
式中以线示键,线的交点与端点处代表碳原子,并用氢原子数补足四价,但C、H原子未
标记出来,关于它的叙述正确的是 ( )
A.维生素A的分子式为C20H28O B.维生素A 是一种易溶于水的醇
C.维生素A即能使溴水褪色,又能被酸性K2Cr2O7 溶液氧化
D.1mol维生素A 在催化剂作用下最多可与7molH2发生加成反应
21.在含有FeCl3和BaCl2的酸性溶液中,通入足量的SO2后有白色沉淀生成,过滤后,向溶液中滴加KSCN溶液,无明显现象,下列叙述正确的是 ( )
A.白色沉淀是BaSO4和BaSO3 B.溶液的酸性减弱
C.白色沉淀是BaSO3 D.溶液中Fe3+全部被还原为Fe2+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com