
题目列表(包括答案和解析)
21.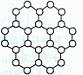 A.(12分)2010年诺贝尔物理学奖授予英国曼彻斯特大学科学家安德烈·海姆和康斯坦丁·诺沃肖洛夫。共同工作多年的二人因“突破性地”用撕裂的方法成功获得超薄材料石墨烯而获奖。制备石墨烯方法有石墨剥离法、化学气相沉积法等。石墨烯的球棍模型示意图如右:
A.(12分)2010年诺贝尔物理学奖授予英国曼彻斯特大学科学家安德烈·海姆和康斯坦丁·诺沃肖洛夫。共同工作多年的二人因“突破性地”用撕裂的方法成功获得超薄材料石墨烯而获奖。制备石墨烯方法有石墨剥离法、化学气相沉积法等。石墨烯的球棍模型示意图如右:
(1)下列有关石墨烯说法正确的是 。
A.石墨烯的结构与金刚石相似
B.石墨烯分子中所有原子可以处于同一平面
C.12g石墨烯含 键数为NA
键数为NA
D.从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力
(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜、钴等金属或合金,含碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合。
 ①钴原子在基态时,核外电子排布式
①钴原子在基态时,核外电子排布式
为 。
②乙醇沸点比氯乙烷高,主要原因
是 。
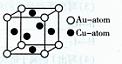
 ③金与铜可形成的金属互化物合金(如图),
③金与铜可形成的金属互化物合金(如图),
它的化学式可表示为 。
④下列含碳源中属于非极性分子的是
a.甲烷
b.乙炔
c.苯
d.乙醇
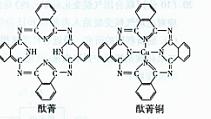
⑤酞菁与酞菁铜染料分子结构如图,酞菁分子中氮原子采用的杂化方式是 ;酞菁铜分子中心原子的配位数为 。
20.(10分)《联合国气候变化框架公约》是世界上第一个为全面控制二氧化碳等温室气体排放,以应对全球气候变暖给人类经济和社会带来不利影响的国际公约。各国科学家们也加强了对CO2创新利用的研究。最近有科学家提出“绿色自由”构想:把空气吹人碳酸钾溶液,然后再把 二氧化碳从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇等。“绿色自由”构想技术流程如下:
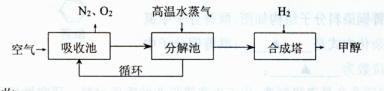
I.二氧化碳的吸收
(1)上述流程中“循环”的意义为 。
(2)吸收池中不用饱和碳酸钠溶液代替饱和碳酸钾溶液可能的原因是 。
(已知:碳酸钾、碳酸钠的价格分别为:5200元/吨、2300元/吨。)
Ⅱ.二氧化碳的利用
(1)2009年我国二氧化碳排放总量约为6.6×109吨,若采用上述流程将二氧化碳转化成甲醇(假设CO2的吸收率为80%,转化率为90%),通过计算确定理论上可制得96c70甲醇多少吨?
(2)工业上常将甲醇加入汽油,制成利于改善城市环境的甲醇汽油。
已知常温下甲醇、汽油及一氧化碳的燃烧热如下:
|
物质 |
甲醇 |
汽油(C8H8) |
一氧化碳 |
|
燃烧热/kJ·mol-l |
725 |
5518 |
283 |
1mol等物质的量的甲醇、汽油(C8 H18)混合的燃料,在一定量的氧气中燃烧,放出热量2980kJ,则反应中生成CO mol。
19.(12分)某制药厂用两种石油裂解气C4H8和C2H4以及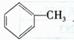 成一种药物K,其合成路线设计如下:
成一种药物K,其合成路线设计如下:
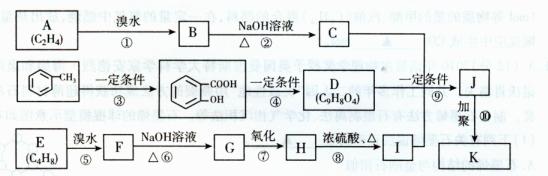
其中G无酸性,H、I有酸性;D可与NaHCO3溶液作用生成气体,并遇FeCl3溶液不显紫色;K的分子式为(C15H16O6)n。请完成下列各题:
(1)上述过程中属于取代反应的是 。
(2)写出结构简式:E ,K 。
(3)写出下列反应的化学方程式:
B→C:
H→I:
(4)写出I的属于链状酯类且其核磁共振氢谱图中有三个吸收峰的同分异构体的结构简式 (任写2个)。
18.(10分)纳米TiO2作为一种光催化剂越来越受到人们的关注,现正广泛开发运用。
(1)制取纳米TiO2的方法很多,氢氧火焰水解法是将TiCl4气体导入氢氧火焰中(700~
1000℃)进行水解,其化学反应式为 。
(2)纳米二氧化钛可光解挥发性有机污染物(VOCs),若无水蒸气存在,三氯乙烯降解反应为:c2HC13+2O2→2CO2+HCl+Cl2,若有足够量的降解后的尾气,实验室检验产物中有氯气的简单方法是
;通过质谱仪发现还有多种副产物,其中之一为: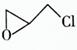 ,则该有机物核磁共振氢谱有 个峰。
,则该有机物核磁共振氢谱有 个峰。
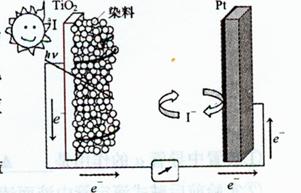
(3)利用半导材料TiO2与染料、铂电极及I3-和I-的混合物作电解质(I2+I- I3-),可构成染料敏化太阳能电池( DSSCs)工作原理如右图,该电池工作时,正极的电极反应为
。
I3-),可构成染料敏化太阳能电池( DSSCs)工作原理如右图,该电池工作时,正极的电极反应为
。
(4)在不同的载体(钛片、铝片、陶瓷)表面制备二氧化钛薄膜,来考察不同载体TiO2薄膜光催化使甲基橙脱色,每次光照20min取一次样,实验结果如下图。
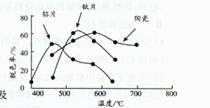 下列说法正确的是
。
下列说法正确的是
。
a.不同载体,无论何种温度一定是钛片最好
b.约在520℃时,钛片载体的光催化活性最好
c.无论何种TiO2催化活性总是随温度的升高而升高
d.不同负载TiO2薄膜的光催化活性不同
17.(10分)
(1)已知:N2(g)+ O2(g)=2NO(g) ;△H = 180.5KJ ·mol-l
4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H= -905KJ·mol-l
2H2(g)+O2(g) =2H2O(g) ;△ H =-483. 6KJ·mol-l
则 N2(g) +3H2(g) 2NH3(g)的△H =
。
2NH3(g)的△H =
。
(2)一定温度下在恒容密闭容器中N2O5可发生下列反应:
2N2O5(g) 4NO2(g)+O2(g);△H>O
4NO2(g)+O2(g);△H>O
①反应达到平衡后若再通人一定量氮气,则N2O5的转化率将 (填“增大”、“减小”、“不变”)。
②下表为反应在T,温度下的部分实验数据:
|
时间/S |
0 |
500 |
1000 |
|
c(N2O5)mol·L-1 |
5.00 |
3.52 |
2.48 |
则500s内N2O5的分解速率为 。
③在T2温度下,反应1000s时测得NO2的浓度为4.98mol·L-1,则T2 T1。
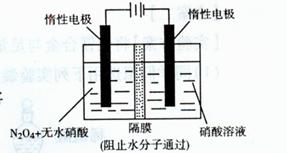
(3)如图所示装置可用于制备N2O5,则N2O5在电解池的 (填“阳极”或“阴极”)区生成,其电极反应式为 。
16.(10分)钡盐行业生产中排出大量的钡泥[主要含有BaCO3、BaSiO3、BaSO3、Ba(FeO2)2等]。某主要生产BaC12、BaCO3、BaSO4的化工厂利用钡泥制取Ba(NO3)2,其部分工艺流程如下:
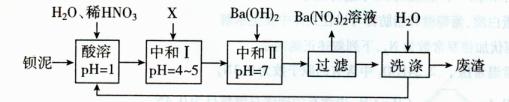
(1)酸溶时通常控制反应温度不超过70℃,且不使用浓硝酸,原因是 、
。
(2)酸溶过程中,除发生了BaSO3+2HNO3=Ba(NO3)2+SO2↑+H2O外,BaSO3与HNO3还发生另一个反应,其离子方程式为 。
(3)结合本厂实际,选用的X为 (填化学式);最后的废渣中除含少量的BaSiO3、H2SiO3(H4SiO4)及原有的难溶性杂质外还含有 (填化学式)。
(4)沉淀转化在生产和科研中具有极其生要的应用。在分析化学中常常先将难溶强酸盐转化为难溶弱酸盐,然后用酸溶解,使阳离子进入溶液。写出BaSO4转化为BaCO3的离子方程式
15. (14分)某化学课外兴趣小组为探究苯与溴发生反应的反应类型并制取纯净的溴苯,进行如下实验。请根据要求回答相关问题。
(14分)某化学课外兴趣小组为探究苯与溴发生反应的反应类型并制取纯净的溴苯,进行如下实验。请根据要求回答相关问题。
I:制取溴苯(装置如图所示)
(1)向烧瓶中滴人溴的苯溶液片刻后,在烧瓶中
可观察到的现象是
(2)锥形瓶中有淡黄色浑浊生成,能否证明苯与
溴发生了取代反应(填“能”或“不能”)
,原因是 。
(3)若不能确定,请从下列装置中选取适宜装置加以改进,请在下面实验流程图的方框中填入序号。
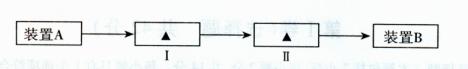
①装有NaOH溶液的洗气瓶 ②装有CC14的洗气瓶
③装有KI溶液的洗气瓶 ④装有湿润淀粉KI试纸的集气瓶
(4)该实验还可用 代替AgNO3溶液检验取代反应的产物之一溴化氢。
Ⅱ:提纯溴苯
(5)反应后所得混合液,经以下几步操作可得到纯净的溴苯。简要写出各操作步骤和目的(不一定填满)。
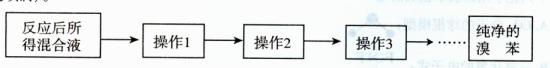
操作l ;目的: 。
操作2 ;目的: 。
操作3 ;目的: 。
操作4 ;目的: 。
14.研究性学习小组进行了一系列化学实验后,发现高锰酸钾分解后的含锰元素的化合物都能和浓盐酸反应制得氯气,且锰化合物的还原产物都是MrlCl2。他们将6.32gKMnO4粉末加热一段时间,也不知道高锰酸钾是否完全分解,收集到0. 112L气体后便停止加热了,冷却后放人足量的浓盐酸再加热,又收集到气体体积是(上述气体体积都折合成标准状况 ( )
A.0. 448L B.2.240L C.2.016L D.无法确定
第Ⅱ卷 (非选择题 共78分)
13.在一定温度下,将等量的气体分别通人起始体积相同的密闭容器I和Ⅱ中,使其发生反应,t0时容器I中达到化学平衡,X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是 ( )
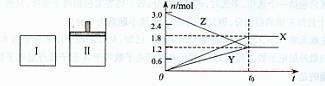
A.该反应的化学方程式为:3X +2Y i 2Z
2Z
B.若两容器中均达到平衡时,两容器的体积V(I)<V(Ⅱ),则容器II达到平衡所需时间大于t0
C.若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态
D.若达平衡后,对容器Ⅱ升高温度时其体积增大,说明Z发生的反应为吸热反应
12.下列溶液中微粒的物质的量浓度关系错误的是 ( )
A.0.1mol·L-1的NaHSO3溶液:c(H+)-c(OH-)=c(SO32-)-2c(H2SO3)
B.1L0.1mol·L-1(NH4)2Fe(SO4)2·6H2O的溶液:
c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-)
C.浓度均为0.1mol·L-1的NaHCO3和Na2CO3混合液:
c(Na+)>c(CO32-)>c(HCO3->c(OH-)>c(H+)
D.向0.0lmol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:
c( Na+)>c( SO42-)>c(NH4+>c(OH-)=c(H+)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com